题目内容
16.现有下列浓度均为0.1mol/L的电解质溶液:①Na2CO3②NaHCO3③NaClO ④CH3COONH4⑤NH4HCO3
(1)上述5种物质的溶液既能与盐酸又能与烧碱溶液反应的是(填写序号)②④⑤.
(2)已知溶液④呈中性,该溶液中离子浓度由大到小的顺序是c(CH3COO-)=c(NH4+)>c(H+)=c(OH-).
(3)已知溶液⑤呈碱性,比较④、⑤两溶液的酸碱性,可以得出的结论是HCO3-的水解程度比CH3COO-大或CH3COOH酸性比H2CO3强.
分析 (1)既能与盐酸又能与烧碱溶液反应的有两性氧化物、两性氢氧化物、弱酸的酸式盐、弱酸弱碱盐等;
(2)根据④呈中性结合电荷守恒判断;
(3)已知溶液⑤呈碱性,④呈中性,说明醋酸酸性比碳酸强.
解答 解:(1)HCO3-既不与酸共存,也不与碱共存;NH4+不与碱共存,CH3COONH4为弱酸弱碱盐,故既能与盐酸反应,又能与烧碱反应的电解质有②④⑤,
故答案为:②④⑤;
(2))④呈中性c(H+)=c(OH-),又电荷守恒为c(H+)+c(NH4+)=c(CH3COO-)+c(OH-),所以离子浓度由大到小的顺序c(CH3COO-)=c(NH4+)>c(H+)=c(OH-),
故答案为:c(CH3COO-)=c(NH4+)>c(H+)=c(OH-);
(3)④呈中性,CH3COONH4是弱酸弱碱盐,溶液呈中性,说明CH3COO-和NH4+水解程度相同,但H2CO3酸性弱于CH3COOH,HCO3-的水解程度大于CH3COO-,所以NH4HCO3溶液pH>7,
故答案为:HCO3-的水解程度比CH3COO-大或CH3COOH酸性比H2CO3强.
点评 本题考查电解质、盐类水解,综合考查学生化学知识的应用能力和分析问题的能力,为高考常见题型,题目难度不大,注意把握盐类水解和弱电解质的电离特点.

练习册系列答案
相关题目
7.已知M(C8Hl602)发生水解反应可生成A、B两种化合物,在一定条件下A可转化为B,则所有A、B反应生成的物质有( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
4.下列有关化学用于表示正确的是( )
| A. | Ba (OH)2溶液与过量NaHCO3溶液混合离子方程式:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| B. | Na+的结构示意图: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 氢氧化铁的电离方程式:Fe(OH)3═Fe3++3OH- |
11.铝灰的回收利用方法很多,现用含有A12O3、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O,工艺流程如图:
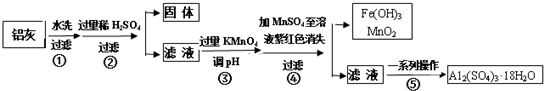
请回答下列问题:
(1)加入过量稀H2SO4溶解A12O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
步骤③的目的是亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去;若在该浓度下除去铁的化合物,调节pH的最大范围是2.8≤PH<3.4.
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2+4H+;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是浓盐酸或双氧水.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B (填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.

请回答下列问题:
(1)加入过量稀H2SO4溶解A12O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2+4H+;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是浓盐酸或双氧水.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B (填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.
1.已知723K时,2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ.则Q1、Q2、Q满足的关系是( )
| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2<Q1<Q | D. | Q=Q1>Q2 |
8.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是( )
| 甲 | 乙 | |
| ① | 物质微粒数 | 阿伏加德罗常数 |
| ② | 标况下气体摩尔体积 | 标况下气体体积 |
| ③ | 溶剂的体积 | 溶质的物质的量浓度 |
| ④ | 溶液中溶质的质量分数 | 溶液的质量 |
| ⑤ | 非标况下物质的质量 | 物质的摩尔质量 |
| A. | ③ | B. | ③④ | C. | ②③④ | D. | ③④⑤ |
5.用试纸检验气体是一种重要的实验方法.下列试纸的选用以及对应的现象、结论都正确的一项是( )
| A. | 用干燥的pH试纸检验CO2 | |
| B. | 用干燥的红色石蕊试纸检验NH3 | |
| C. | SO2能使湿润的品红试纸褪色 | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 |
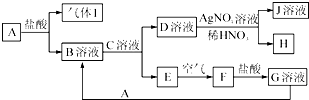 已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色,各物质之间的转化关系如图所示.
已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色,各物质之间的转化关系如图所示. .
.