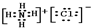题目内容
2.150℃时碳酸铵完全分解的化学方程式为:(NH4)2CO3=2NH3↑+H2O↑+CO2↑,求此时产生的气态混合物在相同条件下对H2的相对密度是多少?分析 由方程式可知,生成的混合气体中氨气、水蒸气、二氧化碳的摩尔分数分别为0.5、0.25、0.25,根据$\overline{Mr}$=Mr1×x1+Mr2×x2+…+Mri×xi计算混合气体平均相对分子质量(其中Mri代表各组分相对分子质量、xi代表各组分摩尔分数),再利用密度之比等于相对分子质量之比计算.
解答 解:由(NH4)2CO3=2NH3↑+H2O↑+CO2↑可知,1mol(NH4)2CO3分解生成的混合气体中氨气、水蒸气、二氧化碳的摩尔分数分别为0.5、0.25、0.25,则混合气体$\overline{Mr}$=17×0.5+18×0.25+44×0.25=24,因气体密度之比等于相对分子质量之比,所以混合气的密度是相同条件下的氢气密度的$\frac{24}{2}$=12倍,
答:产生的气态混合物在相同条件下对H2的相对密度是12.
点评 本题结合铵盐的化学性质考查了阿伏伽德罗定律推论应用等,题目难度不大,注意对基础知识的理解掌握,侧重分析能力及计算能力的考查.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
19.为了防止钢铁锈蚀,下列防护方法中不正确的是( )
| A. | 在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中 | |
| B. | 在海轮舷上用铁丝系住锌板浸在海水里 | |
| C. | 将金属制成防腐蚀的合金如不锈钢 | |
| D. | 在地下输油的铸铁管上接直流电源的负极 |
7.对于处于化学平衡状态的反应CO+H2O(g)?CO2+H2中,K正反应代表正反应的平衡常数,K逆反应代表逆反应的平衡常数,下列有关说法正确的是,( )
| A. | K正反应=K逆反应 | B. | K正反应>K逆反应 | ||
| C. | K正反应<K逆反应 | D. | K正反应×K逆反应=1 |
14.向Na2CO3溶液中逐滴滴入稀盐酸,溶液中的HCO3-浓度的变化情况是( )
| A. | 逐渐增大 | B. | 逐渐减小 | ||
| C. | 先逐渐增大后减小 | D. | 先逐渐减小后增大 |
11.下列物质中,含有非极性键的共价化合物是( )
| A. | Na2O2 | B. | CH3CH3 | C. | NaCl | D. | N2 |
12.已知:①A+B2+=A2++B,②D+2H2O=D(OH)2+H2↑,③以B、C为电极与C的盐溶液组成原电池,电极反应为:C2++2e-=C,B-2e-=B2+.则A2+、B2+、D2+、C2+的氧化性强弱关系是( )
| A. | D2+>A2+>B2+>C2+ | B. | C2+>B2+>A2+>D2+ | C. | D2+>C2+>A2+>B2+ | D. | A2+>B2+>D2+>C2+ |

 、
、