题目内容
18.X、Y、Z、M是四种原子序数依次增大的主族元素.已知X、Y、Z是短周期中的三种非金属元素,X元素原子的核外电子数等于所在周期数;Y原子的最外层电子数是内层电子数的2倍;Z单质为无色气体,性质稳定常用作保护气;M是地壳中含量最高的金属元素.下列说法正确的是( )| A. | 四种元素的原子半径从大到小的顺序是:M>Z>Y>X | |
| B. | 元素X、Z可形成某种化合物,其分子内既含极性键又含非极性键 | |
| C. | 化合物YO2、ZO2都能和氢氧化钠溶液反应,均属于酸性氧化物 | |
| D. | 金属M制品具有较强的抗腐蚀能力,说明M元素的金属活动性较差 |
分析 X、Y、Z、M是四种原子序数依次增大的主族元素,已知X、Y、Z是短周期中的三种非金属元素,X元素原子的核外电子数等于所在周期数,X为H元素;Y原子的最外层电子数是内层电子数的2倍,则Y含有两个电子层,最外层含有4个电子,为C元素;Z单质为无色气体,性质稳定常用作保护气,则Z为N元素;M是地壳中含量最高的金属元素,则M为Al元素,据此进行解答.
解答 解:X、Y、Z、M是四种原子序数依次增大的主族元素,已知X、Y、Z是短周期中的三种非金属元素,X元素原子的核外电子数等于所在周期数,X为H元素;Y原子的最外层电子数是内层电子数的2倍,则Y含有两个电子层,最外层含有4个电子,为C元素;Z单质为无色气体,性质稳定常用作保护气,则Z为N元素;M是地壳中含量最高的金属元素,则M为Al元素,
A.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则四种元素的原子半径从大到小的顺序是:M>Y>Z>X,故A错误;
B.元素X、Z可形成化合物N2H4,其分子内既含极性键N-H键,又含非极性键N-N键,故B正确;
C.化合物YO2为CO2,二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,与水反应生成碳酸,属于酸性氧化物,而NO2与水反应生成硝酸和NO,不属于酸性氧化物,故C错误;
D.M为Al,铝表面能够形成一层致密的氧化膜,则金属M制品具有较强的抗腐蚀能力,但是Al的化学性质比较活泼,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断各元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
9.由甘氨酸(H2N-CH2-COOH)和α-氨基丙酸所组成的混合物在一定条件下可以生成二肽,则二肽的种类有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
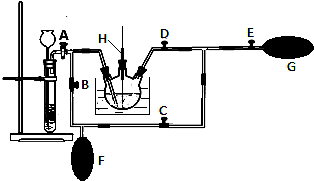
13.实验室制乙酸乙酯得主要装置如图1所示,主要步骤
①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯.

请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑.
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是防止倒吸,步骤⑤中分离乙酸乙酯必须使用的一种仪器是分液漏斗.
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol•L-1.
②分析实验A、C(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动.
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应.
④分离出乙酸乙酯层后,经过洗涤杂质;为了干燥乙酸乙酯可选用的干燥剂为(填字母)B.
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
⑤为充分利用反应物,该同学又设计了图2中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为更合理的是乙.理由是:乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,提高了乙酸、乙醇原料的利用率及产物的产率,而甲不可.
①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯.

请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑.
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是防止倒吸,步骤⑤中分离乙酸乙酯必须使用的一种仪器是分液漏斗.
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
| 实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验A、C(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动.
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应.
④分离出乙酸乙酯层后,经过洗涤杂质;为了干燥乙酸乙酯可选用的干燥剂为(填字母)B.
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
⑤为充分利用反应物,该同学又设计了图2中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为更合理的是乙.理由是:乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,提高了乙酸、乙醇原料的利用率及产物的产率,而甲不可.
3.溶液、胶体和浊液这三种分散系的本质区别是( )
| A. | 是否是大量分子或离子的集合体 | B. | 分散质微粒直径的大小不同 | ||
| C. | 是否有丁达尔效应 | D. | 是否均一、稳定、透明 |
9.以下说法正确的是( )
| A. | 制备乙酸乙酯的实验中,承接酯的小试管中盛放了一定量的氢氧化钠溶液 | |
| B. | 实验室制乙烯时应将无水乙醇缓慢加入到浓硫酸中 | |
| C. | 在酸性重铬酸钾溶液中加入少量乙醇,橙色溶液变红 | |
| D. | 为减缓反应速率,将饱和食盐水滴加到烧瓶中的电石上来制取乙炔 |
 有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1.
有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1.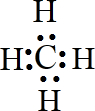 .
.
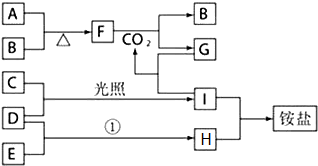 某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.
某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.