题目内容
6.A(g)+3B(g)?2C (g)△H=-b kJ•mol-1,一定条件下,在2L的恒容密闭容器中,反应30min,测得C的物质的量增加了6mol.下列说法正确的是( )| A. | 第30min时,A的反应速率为0.05 mol•L-1•min-1 | |
| B. | 30min内,C的平均反应速率为0.02 mol•L-1•min-1 | |
| C. | 30min内,V(B)=$\frac{1}{3}$V(A) | |
| D. | 30min内,该反应放出的热量为3b kJ |
分析 在2L的恒容密闭容器中,反应30min,测得C的物质的量增加了6mol.则v(C)=$\frac{△c}{△t}$=$\frac{\frac{6mol}{2L}}{30min}$=0.1mol•L-1•min-1,速率之比等于化学计量数之比,物质的量与热量成正比,且速率为平均速率,以此来解答.
解答 解:反应30min,测得C的物质的量增加了6mol.则v(C)=$\frac{△c}{△t}$=$\frac{\frac{6mol}{2L}}{30min}$=0.1mol•L-1•min-1,
A.速率为平均速率,不能计算第30min时A的瞬时速率,故A错误;
B.由上述计算可知,30min内,C的平均反应速率为0.1 mol•L-1•min-1,故B错误;
C.速率之比等于化学计量数之比,则30min内,2v(B)=3v(C),故C错误;
D.物质的量与热量成正比,生成2molC时放出热量为bkJ,则30min内生成6molC,该反应放出的热量为3b kJ,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握速率的计算、反应中热量计算为解答的关键,侧重分析与计算能力的考查,注意速率为平均速率,选项A为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法不正确的是( )
| A. | 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高 | |
| B. | 向盛有5mL 4%和5mL 12%的过氧化氢溶液中分别加入几滴等浓度的氯化铁溶液,后者产生气泡速率快 | |
| C. | KI溶液中加少量新制的氯水,再加少量苯充分振荡后静置,上层为紫红色 | |
| D. | 用pH试纸测溶液的pH和用红色石蕊试纸检测气体时均不需要润湿 |
15.用NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 1L1mol•L-1KClO3溶液中含有的氯离子数目为NA | |
| B. | 22.4LH2含有的分子数目为NA | |
| C. | 等质量的C2H2与C6H6含有的原子总数相等 | |
| D. | 1molZn变为Zn2+时失去的电子数目为NA |
 +CH2═CH-M$→_{碱}^{Pb}$
+CH2═CH-M$→_{碱}^{Pb}$ =CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
=CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: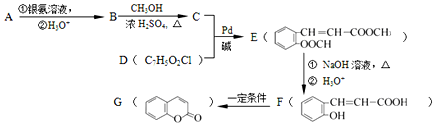
 .
. 中任意2种.
中任意2种. 的路线流程图:
的路线流程图: .
.