题目内容
2. 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:(1)从开始至2min末,Z的平均反应速率为0.075mol/(L•min);
(2)该反应的化学方程式为3X+Y?3Z;
(3)为使该反应的反应速率增大,下列措施一定正确的是bcd.
a.及时分离出Z气体 b.适当升高温度
c.增大X的浓度 d.选择高效催化剂
(4)已知该反应器起始压强为P0,达到平衡时混合气体总压强为P,请用P0、P来表示平衡时反应物X的转化率为$\frac{6({P}_{0}-P)}{{P}_{0}}×100%$.
(提示:物质的转化率=$\frac{反应物转化的物质的量}{反应物起始的物质的量}$×100%)
分析 (1)分析图象计算Z的消耗物质的量为0.2mol,结合反应速率概念计算,V=$\frac{△c}{△t}$;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)a.及时分离出Z气体,生成物的浓度减小,反应速率减慢;
b.适当升高温度,反应速率加快;
c.增大X的浓度,正逆反应速率都加快;
d.选择高效催化剂,加快化学反应速率;
(4)压强之比等于物质的量之比,由方程式可知:3X+Y?3Z,反应前总物质的量为2mol,所以X的分压为$\frac{{P}_{0}}{2}$,反应后总物质的量1.9mol,所以总物质的量减少0.1mol,而压强变化量为:P0-P,所以X的压强变化量为:3(P0-P),由此分析解答.
解答 解:(1)图象计算Z的消耗物质的量为0.3mol,从开始至2min,Z的平均反应速率=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol/(L•min),故答案为:0.075mol/(L•min);
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.3mol=3:1:3,则反应的化学方程式为:3X+Y?3Z,
故答案为:3X+Y?3Z;
(3)a.及时分离出Z气体,生成物的浓度减小,反应速率减慢,故错误; b.适当升高温度,反应速率加快,故正确;
c.增大X的浓度,正逆反应速率都加快,故正确; d.选择高效催化剂,加快化学反应速率,故正确;故选bcd;
(4)反应前总物质的量为2mol,所以X的分压为$\frac{{P}_{0}}{2}$,反应后总物质的量1.9mol,所以总物质的量减少0.1mol,而压强变化量为:P0-P,所以X的压强变化量为:3(P0-P),X的转化率为$\frac{3({P}_{0}-P)}{\frac{{P}_{0}}{2}}$×100%=$\frac{6({P}_{0}-P)}{{P}_{0}}×100%$,故答案为:$\frac{6({P}_{0}-P)}{{P}_{0}}×100%$.
点评 本题考查了化学反应速率,影响化学反应速率的因素,图象分析和反应进行方向的判断方法是解题关键,题目较简单.

 发散思维新课堂系列答案
发散思维新课堂系列答案 为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置,加热A中的AgNO3固体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色固体Ag.(夹持及加热仪器均省略)
(1)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(2)甲同学认为仅凭试管A中有红棕色的气体产生就判定有NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排净装置中的空气,你是否同意他的观点?并说明理由:否;硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+或Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.完成如表:
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | 白色沉淀 | 除尽Ag+ |
| (2)取少量上层清液于试管中,加入取少量上述溶液于试管中加入 KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上层清液于试管中,加入加入 酸性KMnO4溶液,振荡 | 紫红色消失 | 存在Fe2+ |
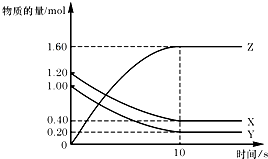 T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 平衡时X、Y的转化率相同 | |
| B. | 达到平衡后,将容器体积压缩为1L,平衡向正反应方向移动 | |
| C. | T℃时,该反应的化学方程式为:X(g)+Y(g)?2Z(g),平衡常数K=40 | |
| D. | T℃时,若起始时X为0.71mol,Y为1.00mol,则平衡时Y的转化率为60% |
| A. | Na+、H+、Al3+、CH3COO- | B. | Mg2+、HCO3-、Ca2+、NO3- | ||
| C. | K+、MnO4-、Cl-、Cu2+ | D. | NH4+、Cl-、K+、OH- |
| A. | 将40gNaOH溶于1L水中所得的溶液 | |
| B. | 将58.5gNaCl溶于水配成1L溶液 | |
| C. | 将0.5mol•L-1氯化钠溶液100mL加热蒸发掉50g水的溶液 | |
| D. | 含K+为2mol的K2SO4溶液 |