题目内容
3.NO和CO都是汽车尾气里的有害物质,它们能缓缓地反应生成N2和CO2,化学方程式为:2NO+2CO$\stackrel{催化剂}{?}$N2+2CO2,对此反应,下列叙述错误的是( )| A. | 使用正催化剂能加大反应速率 | |
| B. | 改变反应物的压强对反应速率产生影响 | |
| C. | 冬天气温低,反应速率降低,对人体危害更大 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
分析 A.催化剂可改变反应速率;
B.该反应有气体参加;
C.降低温度,反应速率减小;
D.温度、浓度、压强、催化剂均可改变反应速率.
解答 解:A.催化剂可改变反应速率,则用正催化剂能加大反应速率,故A正确;
B.该反应有气体参加,则改变反应物的压强对反应速率产生影响,故B正确;
C.降低温度,反应速率减小,则冬天气温低,反应速率降低,对人体危害更大,故C正确;
D.温度、浓度、压强、催化剂均可改变反应速率,反应速率受外界条件的影响,故D错误;
故选D.
点评 本题考查反应速率的影响因素,为高频考点,把握温度、浓度、压强、催化剂对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列离子方程式书写正确的是( )
| A. | 用醋除水垢的原理CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 氯碱工业中电解饱和食盐水2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | NaHSO4溶液中滴加Ba(OH)2溶液至中性H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 酸性溶液中KIO3与KI反应生成I2 IO3-+I-+6H+═I2+3H2O |
14.下列各溶液中,粒子的物质的量浓度关系表述正确的是( )
| A. | (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 氨水中,c(OH-)=c(NH4+) | |
| D. | NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3•H2O) |
11.下列说法正确的是( )
| A. | 可以通过电解熔融AlCl3来冶炼铝 | |
| B. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 非极性键不只存在于双原子单质分子中 | |
| D. | 分解反应都是吸热反应,化合反应都是放热反应 |
18.KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火.实验室用KClO3和MnO2混合加热制氧气,现取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃).
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为11.80g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
①则25℃时KCl的溶解度为35g/100g水;
②原混合物中KClO3的质量为12.25g;
(3)MnO2是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和加热装置已略).

①制备氯气选用的药品为MnO2和浓盐酸,相应的离子方程式为MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O.
②装置B的作用是除杂和安全瓶.实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:锥形瓶中的液面下降,长颈漏斗中的液面上升.
③装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c(选“a”“b”或“c”).
④设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴.打开活塞,将D中的少量溶液加入E中,振荡E,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.该现象不能(填“能”或“不能”)说明溴的非金属性强于碘,原因是过量的Cl2也可将I-氧化为I2.
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为11.80g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
①则25℃时KCl的溶解度为35g/100g水;
②原混合物中KClO3的质量为12.25g;
(3)MnO2是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和加热装置已略).

①制备氯气选用的药品为MnO2和浓盐酸,相应的离子方程式为MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O.
②装置B的作用是除杂和安全瓶.实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:锥形瓶中的液面下降,长颈漏斗中的液面上升.
③装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c(选“a”“b”或“c”).
| a | b | c | |
| Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
1.常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1CH3COOH 溶液和HCN溶液,所得滴定曲线如图.下列说法不正确的是( )


| A. | 点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-) | |
| B. | 点③时:c(Na+)=c(CH3COO-)>c(H+) | |
| C. | 点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
19.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将硫的酒精溶液滴入一定量的热水中得微蓝色透明液体,用激光笔照射 | 有丁达尔效应 | 微蓝色透明液体为胶体 |
| B | 将FeSO4高温强热,得红色固体,产生的气体通入BaCl2溶液 | 产生白色沉淀 | 白色沉淀为BaSO4和BaSO3 |
| C | 取将气体X分别通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
| D | 向溶液Y中滴加硝酸,再滴加BaCl2溶液 | 有白色沉淀 | Y中一定含有SO42- |
| A. | A、 | B. | B | C. | C | D. | D |

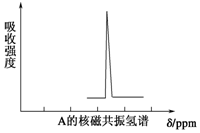 有一种新合成的高度对称的有机物A.已知10.4g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重7.2g和35.2g,经检验剩余气体为O2.
有一种新合成的高度对称的有机物A.已知10.4g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重7.2g和35.2g,经检验剩余气体为O2.
 ,其核磁共振氢谱有5个吸收峰.
,其核磁共振氢谱有5个吸收峰.