题目内容
如图中的所有物质均由短周期元素组成.其中甲、乙、丙、丁为单质,常温下甲、乙为无色气体、丁为黄绿色气体.丙是常见金属,广泛用于航天、航空工业,工业上从海水中提取G后再通过电解G制取丙、同时得到副产物丁.A、E的分子均含10个电子,A是一种能使湿润的红色石蕊试纸变蓝的气体,E常温下是无色无味的液体.框图中各物质转化所涉及的条件均已省略.回答下列问题:
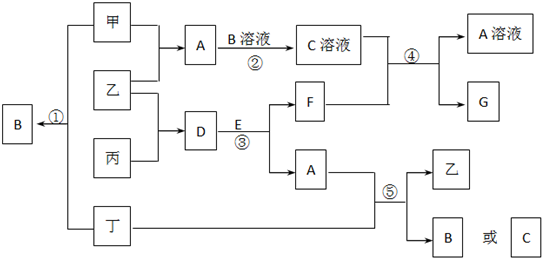
(1)反应①~⑤中属于氧化还原反应的是 (填序号).
(2)画出丙的原子结构示意图 ,写出A的电子式 ,写出A、B的等电子体(原子数和电子数均相等的粒子) 、 (用化学式表示).
(3)按要求写出下列化学方程式或离子方程式:
①C的水溶液显酸性,用离子方程式解释之 ;
②过量的A与丁反应的化学方程式 ;
(4)说出丁在工业生产或生活中的一种用途 .

(1)反应①~⑤中属于氧化还原反应的是
(2)画出丙的原子结构示意图
(3)按要求写出下列化学方程式或离子方程式:
①C的水溶液显酸性,用离子方程式解释之
②过量的A与丁反应的化学方程式
(4)说出丁在工业生产或生活中的一种用途
考点:无机物的推断
专题:推断题
分析:常温下甲、乙为无色气体、丁为黄绿色气体,丁为Cl2.丙是常见金属,广泛用于航天、航空工业,工业上从海水中提取G为MgCl2,再通过电解G制取丙为Mg、同时得到副产物丁(Cl2).A、E的分子均含10个电子,A是一种能使湿润的红色石蕊试纸变蓝的气体为NH3,推断甲和乙单质化合生成氨气,说明甲、乙是氢气和氮气;甲和氯气反应生成氯化氢,可知,甲为H2,乙为N2,B为HCl;D为 Mg3N2,E常温下是无色无味的液体为H2O;C为NH4Cl,F为Mg(OH)2,A+丁=乙+B或C,则判断为:Cl2+NH3→N2+HCl(NH4Cl),以此解答该题.
解答:
解:常温下甲、乙为无色气体、丁为黄绿色气体,丁为Cl2.丙是常见金属,广泛用于航天、航空工业,工业上从海水中提取G为MgCl2,再通过电解G制取丙为Mg、同时得到副产物丁(Cl2).A、E的分子均含10个电子,A是一种能使湿润的红色石蕊试纸变蓝的气体为NH3,推断甲和乙单质化合生成氨气,说明甲、乙是氢气和氮气;甲和氯气反应生成氯化氢,可知,甲为H2,乙为N2,B为HCl;D为 Mg3N2,E常温下是无色无味的液体为H2O;C为NH4Cl,F为Mg(OH)2,A+丁=乙+B或C,则判断为:Cl2+NH3→N2+HCl(NH4Cl),
(1)由以上分析可知①为氯气和氢气的反应,为氧化还原反应,②为氨气和氯化氢的反应,不是氧化还原反应,③为氮化镁的水解反应,不是氧化还原反应,④为氯化铵与氢氧化镁的反应,为复分解反应,⑤氯气和氨气的反应,为氧化还原反应,故答案为:①⑤;
(2)丙为Mg,原子核对有3个电子层,最外层电子数为2,原子结构示意图为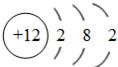 ,A为NH3 ,是共价化合物,电子式为:
,A为NH3 ,是共价化合物,电子式为: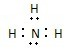 ,A、B的等电子体分别为H3O+、HS-,
,A、B的等电子体分别为H3O+、HS-,
故答案为: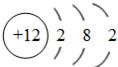 ;
;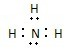 ;H3O+;HS-;
;H3O+;HS-;
(3)①C为NH4Cl,水解呈酸性,方程式为NH4++H2O?NH3?H2O+H+,故答案为:NH4++H2O?NH3?H2O+H+;
②过量的A与丁反应的化学方程式为8NH3+3Cl2=6NH4Cl+N2,故答案为:8NH3+3Cl2=6NH4Cl+N2;
(4)丁为氯气,可用于自来水消毒、制取漂白粉、制取盐酸、制农药等,故答案为:自来水消毒、制取漂白粉、制取盐酸、制农药等.
(1)由以上分析可知①为氯气和氢气的反应,为氧化还原反应,②为氨气和氯化氢的反应,不是氧化还原反应,③为氮化镁的水解反应,不是氧化还原反应,④为氯化铵与氢氧化镁的反应,为复分解反应,⑤氯气和氨气的反应,为氧化还原反应,故答案为:①⑤;
(2)丙为Mg,原子核对有3个电子层,最外层电子数为2,原子结构示意图为
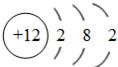 ,A为NH3 ,是共价化合物,电子式为:
,A为NH3 ,是共价化合物,电子式为: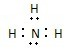 ,A、B的等电子体分别为H3O+、HS-,
,A、B的等电子体分别为H3O+、HS-,故答案为:
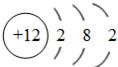 ;
;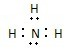 ;H3O+;HS-;
;H3O+;HS-;(3)①C为NH4Cl,水解呈酸性,方程式为NH4++H2O?NH3?H2O+H+,故答案为:NH4++H2O?NH3?H2O+H+;
②过量的A与丁反应的化学方程式为8NH3+3Cl2=6NH4Cl+N2,故答案为:8NH3+3Cl2=6NH4Cl+N2;
(4)丁为氯气,可用于自来水消毒、制取漂白粉、制取盐酸、制农药等,故答案为:自来水消毒、制取漂白粉、制取盐酸、制农药等.
点评:本题考查了物质转化关系和物质性质的综合应用,为高频考点,主要考查氯气、氨气、镁等物质性质的推断和反应特征应用,电子式书写,化学方程式书写,等电子体的判断等知识,题目难度中等.

练习册系列答案
相关题目
乙醇可以发生下列反应,在反应中乙醇分子断裂C-O键而失去羟基的是( )
| A、乙醇在浓硫酸存在下发生消去反应 |
| B、乙醇与金属钠反应 |
| C、乙醇的酯化反应 |
| D、乙醇在铜丝存在条件下发生催化氧化 |
某无色溶液中只可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是( )
下列结论正确的是( )
| 步骤 | 操 作 | 现 象 |
| (1) | 取少许溶液向其中滴加稀盐酸 | 有气泡产生 |
| (2) | 另取少许溶液向其中滴加氯水,及CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 将(3)过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是③④⑤ |
| B、肯定没有的离子是②⑤ |
| C、可能含有的离子是①⑥ |
| D、不能确定的离子是③⑥ |
紫罗兰α鸢尾酮香料的分子结构如图所示,下列说法中不正确的是( )
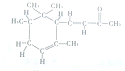

| A、α-鸢尾酮可与某种酚互为同分异构体 |
| B、1mol α-鸢尾酮最多可与2mol H2加成 |
| C、α-鸢尾酮能发生银镜反应 |
D、α-鸢尾酮经加氢→消去反应可转变为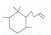 |


 煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等.
煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等.