题目内容
下列说法正确的是( )
| A、在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
| B、相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
| C、在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,都不可以得到该固体:①氯化铝②碳酸氢钠③碳酸钠④偏铝酸钠 |
| D、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:A.c(Na+)=c(CH3COO-)时,根据电荷守恒可知,溶液显示中性,可以加入少量的醋酸实现;
B.氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,只随温度变化;依据溶度积是常数分别依据离子浓度越小沉淀溶解平衡的程度分析判断;
C.氯化铝中铝离子水解生成氢氧化铝和氯化氢,蒸干灼烧最后得到的是氧化铝、碳酸氢钠加热分解生成碳酸钠;
D.醋酸在稀释过程中,电离程度增大,但是溶液中氢离子浓度减小,溶液的pH增大.
B.氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,只随温度变化;依据溶度积是常数分别依据离子浓度越小沉淀溶解平衡的程度分析判断;
C.氯化铝中铝离子水解生成氢氧化铝和氯化氢,蒸干灼烧最后得到的是氧化铝、碳酸氢钠加热分解生成碳酸钠;
D.醋酸在稀释过程中,电离程度增大,但是溶液中氢离子浓度减小,溶液的pH增大.
解答:
解:A.醋酸钠溶液中醋酸根离子部分水解,溶液显示碱性,可以加入少量的醋酸,使溶液显示中性,根据电荷守恒可得,中性时c(Na+)=c(CH3COO-),故A正确;
B.通过溶度积是一定温度下的常数,分别得到:①蒸馏水中含银离子浓度和氯离子浓度相同,氯化银正常溶解;②0.1mol?L-1盐酸溶液中氯离子浓度为0.1mol/L;抑制溶解沉淀平衡;③0.1mol?L-1MgCl2溶液中Cl-浓度为0.2mol/l,抑制沉淀溶解平衡;④0.1mol/L硝酸银溶液中Ag+浓度为0.1mol/L;氯离子都抑制沉淀溶解,所以Cl-浓度越大,Ag+浓度越小,则溶液中Ag+离子浓度大小为:④>①>②>③,故B错误;
C.③碳酸钠④偏铝酸钠溶液蒸干灼烧后仍然得到原固体,而氯化铝中铝离子水解生成氢氧化铝和氯化氢,蒸干灼烧最后得到的是氧化铝、碳酸氢钠加热分解生成碳酸钠,不会得到原固体,故C错误;
D.稀醋酸加水稀释,醋酸电离程度增大,但是溶液中氢离子浓度减小,氢氧根离子浓度增大,溶液的pH增大,故D错误;
故选A.
B.通过溶度积是一定温度下的常数,分别得到:①蒸馏水中含银离子浓度和氯离子浓度相同,氯化银正常溶解;②0.1mol?L-1盐酸溶液中氯离子浓度为0.1mol/L;抑制溶解沉淀平衡;③0.1mol?L-1MgCl2溶液中Cl-浓度为0.2mol/l,抑制沉淀溶解平衡;④0.1mol/L硝酸银溶液中Ag+浓度为0.1mol/L;氯离子都抑制沉淀溶解,所以Cl-浓度越大,Ag+浓度越小,则溶液中Ag+离子浓度大小为:④>①>②>③,故B错误;
C.③碳酸钠④偏铝酸钠溶液蒸干灼烧后仍然得到原固体,而氯化铝中铝离子水解生成氢氧化铝和氯化氢,蒸干灼烧最后得到的是氧化铝、碳酸氢钠加热分解生成碳酸钠,不会得到原固体,故C错误;
D.稀醋酸加水稀释,醋酸电离程度增大,但是溶液中氢离子浓度减小,氢氧根离子浓度增大,溶液的pH增大,故D错误;
故选A.
点评:本题考查了离子浓度大小比较、难溶物溶解平衡、盐的水解原理及其应用等知识,题目难度中等,注意掌握盐的水解原理、难溶物溶解平衡及其应用方法,能够根据盐的水解原理、电荷守恒等判断溶液中离子浓度大小.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列说法不正确的是( )
| A、青铜中含有的主要合金元素是锡和铅 |
| B、装运浓硫酸的铝罐车,在卸货后不能用水冲洗铝罐的内部 |
| C、半导体工业所说的“从沙滩到用户”是指将二氧化硅制成晶体硅 |
| D、氮的固定只有在高温、高压、催化剂的条件下才能实现 |
下列说法正确的是( )
①分子组成为C4H10O的醇有4种
②1mol CH≡CH与足量的HCl加成后再与Cl2发生取代反应,反应完全共需4mol Cl2
③(CH3)3CCH2CH3的一氯代物有3种
④石油裂解和油脂皂化都是由高分子生成小分子的过程.
①分子组成为C4H10O的醇有4种
②1mol CH≡CH与足量的HCl加成后再与Cl2发生取代反应,反应完全共需4mol Cl2
③(CH3)3CCH2CH3的一氯代物有3种
④石油裂解和油脂皂化都是由高分子生成小分子的过程.
| A、①②③④全正确 |
| B、只有①②③正确 |
| C、只有①③正确 |
| D、只有①③④正确 |
晶体具有各向异性.如蓝晶石(Al2O3?SiO2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000.晶体各向异性的主要表现是( )
①硬度 ②导热性 ③导电性 ④光学性质.
①硬度 ②导热性 ③导电性 ④光学性质.
| A、①③ | B、②④ |
| C、①②③ | D、①②③④ |
一氧化碳、烯烃和氢气在催化剂作用下发生烯烃的醛化反应,又叫羰基的合成.如由乙烯可制丙醛:CH2=CH2+CO+H2→CH3CH2CHO,由丁烯进行醛化反应也可得到醛,在它的同分异构体中属于醛的共有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
下列说法正确的是( )
A、金属的晶胞如图所示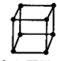 ,其配位数为8 ,其配位数为8 | ||||||||
| B、SO2分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为sp3杂化,是直线型分子 | ||||||||
| C、醋酸钠溶液中离子浓度的关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | ||||||||
D、已知反应2CH3OH(g)?CH3OCH3+H2O(g),某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量CH3OH,某时刻测得各组分浓度如下表,则此时正、逆反应速率的大小关系为:v正>v逆
|
化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
| A、神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| B、食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
| C、人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
| D、针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 |
设为阿伏伽德罗常数的值,下列有关叙述正确的是( )
| A、100mL 18mol?L-1浓硫酸与足量铜反应,转移电子数为1.8NA |
| B、0.5L 0.2mol?L-1氯化铁溶液中Fe3+数目为0.1NA |
| C、0.4mol SiO2晶体中所含的共价键数目为1.6NA |
| D、已知t℃时,MgCO3的K=4.0×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3NA |