题目内容
1.某温度下,0.1mol/L的氢硫酸溶液中存在平衡:①H2S(aq)?H+(a)+HS-(aq); ②HS-(aq)?H+(aq)+S2-(aq);
(1)氢硫酸溶液中存在的离子有H+、HS-、S2-、OH-.(不完整不给分)
(2)若向H2S溶液中C
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小.
分析 (1)依据氢硫酸溶液中存在得到了平衡分析存在的离子;
(2)根据平衡移动原理分析,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,加水稀释促进氢硫酸的电离,但各离子浓度减小.
解答 解:(1)氢硫酸溶液中存在三个平衡,①H2S(aq)?H+(aq)+HS-(aq); ②HS-(aq)?H+(aq)+S2-(aq),③H2O?H+(aq)+OH-(aq); 氢硫酸溶液中存在的离子有H+、HS-、S2-、OH-,
故答案为:H+、HS-、S2-、OH-;
(2)A.加水稀释促进硫化氢电离,但氢离子浓度减小,故A错误;
B.二氧化硫和硫化氢反应方程式为SO2+2H2S=3S↓+2H2O,通入过量二氧化硫平衡向左移动,二氧化硫和水反应方程式为H2O+SO2=H2SO3,亚硫酸酸性大于氢硫酸,所以溶液的pH减小,故B错误;
C.氯气和硫化氢反应方程式为Cl2+H2S=S↓+2HCl,通入氯气平衡向左移动,盐酸的酸性大于氢硫酸,所以溶液的pH减小,故C正确;
D.加入硫酸铜溶液发生反应CuSO4+H2S=H2SO4+CuS↓,硫酸的酸性大于氢硫酸,所以氢离子浓度增大,故D错误;
故答案为:C.
点评 本题考查弱电解质的电离,明确离子间发生的反应是解本题关键,注意加水稀释时,虽然促进氢硫酸电离,但氢离子浓度减小,溶液的pH增大,为易错点.

练习册系列答案
相关题目
12.分类法是重要的科学研究方法,下列物质归类正确的是( )
| A. | 碱:苛性钠、纯碱、熟石灰 | |
| B. | 盐:胆矾、小苏打、铜绿 | |
| C. | 碱性氧化物:氧化铜、七氧化二锰、氧化铝 | |
| D. | 无丁达尔现象的分散系:碘的四氧化碳溶液、淀粉溶液、氯化铁溶液 |
9.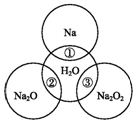 如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
 如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 反应③最多能产生0.1 mol O2 | |
| B. | 反应①的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2O2中阴阳离子数目之比为1:1 | |
| D. | ①②③充分反应后所得溶液中溶质的质量分数:②=③>① |
16.下列说法正确的是( )
| A. | 氯化氢的摩尔质量为36.5g | |
| B. | 1mol H2SO4 的质量为98 g.mol-1 | |
| C. | 任何物质的摩尔质量都等于他的相对分子质量或相对原子质量 | |
| D. | CO2 的摩尔质量是H2 的摩尔质量的22倍 |
6. 如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )
如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )
 如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )
如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )| A. | 左高右低 | B. | 左低右高 | C. | 左右一样高 | D. | 来回振动 |
13.某体积可变的密闭容器,盛有适量的A、B混合气体,在一定条件下发生反应A(g)+3B(g)?2C(g).若维持温度和压强不变,当反应达到限度时容器的体积为VL,其中C气体的体积分数占10%.下列推断正确的是( )
| A. | 原混合气体的体积为1.1VL | |
| B. | 原混合气体的体积为1.2VL | |
| C. | 反应达到限度时,气体A消耗掉0.05 VL | |
| D. | 反应达到限度时,气体B消耗掉0.05 VL |
10.在水中放入高锰酸钾晶体后,可以清楚地看到,溶液中紫红色范围逐渐扩大,最后整个溶液都变成紫红色,原因是( )
| A. | 钾离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散 | |
| B. | 高锰酸根离子受到钾离子的作用,克服了离子间的斥力,逐渐向水中扩散 | |
| C. | 高锰酸根离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散 | |
| D. | 高锰酸钾是强氧化剂,水被氧化 |
11.a、b、c是同周期的三种短周期元素.a的原子结构示意图为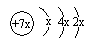 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为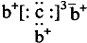 ,下列比较中正确的是( )
,下列比较中正确的是( )
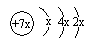 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为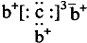 ,下列比较中正确的是( )
,下列比较中正确的是( )| A. | 原子半径:a>b>c | B. | 非金属性:a>c | ||
| C. | 氢化物的稳定性:c>a | D. | 最高价含氧酸的酸性:c>a |