题目内容
X、Y、Z、W、N为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高.N原子外围未成对电子数是同周期中最多的.W元素的电离能数据见下表(kJ?mol-1):
请回答:
(1)W2Y2含有的电子式为 .灼烧W2Y2时,火焰呈特殊颜色,请从原理上解释产生该现象的原因: .
(2)N元素基态原子的外围电子排布式是: .
(3)X3-的空间构型是 ,中心原子的杂化方式是 .
(4)用氢键表示式写出Z的氢化物水溶液中存在的氢键 .
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(1)W2Y2含有的电子式为
(2)N元素基态原子的外围电子排布式是:
(3)X3-的空间构型是
(4)用氢键表示式写出Z的氢化物水溶液中存在的氢键
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W、N为前四周期五种元素,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高,则X为N、Y为O、Z为F;五元素分别位于周期表中三个紧邻的周期,则W处于第三周期,N处于第四周期,W的第二电离能剧增,说明W最外层电子数为1,故W为Na;N原子外围未成对电子数是同周期中最多的,则其外围电子排布为3d54s1,故N为Cr,据此解答.
解答:
解:X、Y、Z、W、N为前四周期五种元素,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高,则X为N、Y为O、Z为F;五元素分别位于周期表中三个紧邻的周期,则W处于第三周期,N处于第四周期,W的第二电离能剧增,说明W最外层电子数为1,故W为Na;N原子外围未成对电子数是同周期中最多的,则其外围电子排布为3d54s1,故N为Cr,
(1)Na2O2含有的电子式为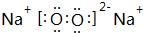 ,灼烧Na2O2时,火焰呈特殊颜色,产生该现象的原因:在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色,
,灼烧Na2O2时,火焰呈特殊颜色,产生该现象的原因:在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色,
故答案为: ;在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色;
;在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色;
(2)N处于第四周期,原子外围未成对电子数是同周期中最多的,则其外围电子排布为3d54s1,故答案为:3d54s1;
(3)N3-中心N原子孤电子对数=
=0,价层电子对数=2+0=2,故其空间构型是直线型,中心N原子的杂化方式是sp杂化,故答案为:直线型;sp;
(4)HF水溶液中HF分子之间、水分子之间、HF与水分子之间都存在氢键,可能存在的氢键为 ,
,
故答案为: .
.
(1)Na2O2含有的电子式为
 ,灼烧Na2O2时,火焰呈特殊颜色,产生该现象的原因:在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色,
,灼烧Na2O2时,火焰呈特殊颜色,产生该现象的原因:在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色,故答案为:
 ;在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色;
;在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色;(2)N处于第四周期,原子外围未成对电子数是同周期中最多的,则其外围电子排布为3d54s1,故答案为:3d54s1;
(3)N3-中心N原子孤电子对数=
| 5+1-3×2 |
| 2 |
(4)HF水溶液中HF分子之间、水分子之间、HF与水分子之间都存在氢键,可能存在的氢键为
 ,
,故答案为:
 .
.
点评:本题是对物质结构的考查,涉及电离能、核外电子排布、电子式、分子结构、杂化轨道、氢键等,侧重对物质结构主干知识的考查,难度不大,注意理解电离能与原子结构、化合价的关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某有机物的结构简式为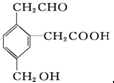 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )
①加成 ②银镜反应 ③酯化 ④氧化 ⑤中和 ⑥金属钠.
 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )①加成 ②银镜反应 ③酯化 ④氧化 ⑤中和 ⑥金属钠.
| A、②③④ | B、①③⑤⑥ |
| C、①③④⑤ | D、①②③④⑤⑥ |
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.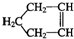 可简写为
可简写为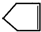 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: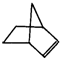
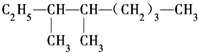 的系统命名法名称是
的系统命名法名称是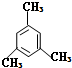 的名称是
的名称是
 ),该反应的原子利用率为100%,反应的化学方程式为
),该反应的原子利用率为100%,反应的化学方程式为