题目内容
6.将13.0g Al、Zn、Mg、Cu组成的合金溶于适量的稀硫酸溶液中,稀硫酸恰好完全反应,产生气体6.72L(标准状况).则反应后的溶液中溶质的质量可能是( )| A. | 28.8g | B. | 34.2g | C. | 39.2g | D. | 48.3g |
分析 生成氢气的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,稀硫酸恰好完全反应,根据H2~H2SO4可知反应后溶质中硫酸根离子的物质的量为0.3mol,该硫酸根离子的质量为:96g/mol×0.3mol=28.8g;由于Cu不与硫酸反应,则反应后溶质中含有金属离子的质量小于13.0g,据此可计算出反应后的溶液中溶质的最大质量;
当金属完全为铝时,反应后溶质中金属离子的质量最小,根据电子守恒铝离子的最小物质的量为:$\frac{0.3mol×2}{3}$=0.2mol,铝离子的质量为:27g/mol×0.2mol=5.4g,由于合金中含有Zn、Mg、Cu,据此可计算出反应后溶质的最小质量,根据计算结果进行判断.
解答 解:生成氢气的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,稀硫酸恰好完全反应,根据H2~H2SO4可知反应后溶质中硫酸根离子的物质的量为0.3mol,质量为:96g/mol×0.3mol=28.8g,由于Cu不与硫酸反应,则反应后溶质中含有金属离子的质量小于13.0g,反应后的溶液中溶质的质量小于13.0g+28.8g=41.8g;
当金属完全为铝时,反应后溶质中金属离子的质量最小,根据电子守恒铝离子的最小物质的量为:$\frac{0.3mol×2}{3}$=0.2mol,铝离子的质量为:27g/mol×0.2mol=5.4g,由于合金中含有Zn、Mg、Cu,则反应后溶质质量大于5.4g+28.8g=34.2g,
根据分析可知,反应后的溶液中溶质的质量范围为:34.2g<m(溶质)<41.8g,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握极值法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液pH=7 | |
| B. | 25℃时,0.2 mol•L-1 Ba(OH)2溶液和0.2 mol•L-1 HCl等体积混合,所得溶液pH=7 | |
| C. | 25℃时,0.2 mol•L-1 NaOH溶液和0.2 mol•L-1 CH3COOH恰好中和,所得溶液pH=7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液pH>7 |
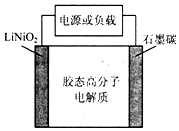 聚合物锂离子电池是以Li+嵌入化合物为正、负极的二次电池.如图为一种聚合物锂离子电池示意图,其工作原理为LiNiO2+6C$?_{放电}^{充电}$ Li1-xNiO2+LixC6.下列说法错误的是( )
聚合物锂离子电池是以Li+嵌入化合物为正、负极的二次电池.如图为一种聚合物锂离子电池示意图,其工作原理为LiNiO2+6C$?_{放电}^{充电}$ Li1-xNiO2+LixC6.下列说法错误的是( )| A. | 电池放电或充电时,通过胶态高分子电解质的微粒是Li+ | |
| B. | 充电过程发生氧化反应的电极反应式为LiNiO2-xe-═Li1-xNiO2+xLi+ | |
| C. | 一段时间内Li0.4C6转化为Li0.9C6发生的是放电过程 | |
| D. | 该电池过充电可能引起电池负极发生金属锂沉积 |
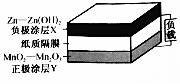 未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )
未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )| A. | 放电电流由负极涂层经外电路流向正极涂层 | |
| B. | 充电时正极涂层与外接电源正极相连,发生还原反应 | |
| C. | 放电时每消耗65 g Zn通过纸质隔膜的电子为2 mol | |
| D. | 充电时阳极反应式为Mn2O3+2OH--2e-═2MnO2+H2O |
| A. | 硫酸亚铁溶液中通入氯气 Fe2++Cl2═Fe3++Cl- | |
| B. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ | |
| C. | 石灰乳与稀盐酸反应OH-+H+═2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| A. | 蒸馏操作时,温度计水银球靠近蒸馏烧瓶的底部,且向蒸馏液体中加入几块沸石,以防止暴沸 | |
| B. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 | |
| C. | 焰色反应每次实验都要先用稀硫酸洗净铂丝 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| 选项 | 操作 | 现象 | 结论 |
| A | 在AlCl3溶液中滴加过量氨水 | 有白色沉淀生成 | 实验室常用此法制备Al(OH)3 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化 | 滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | NaHCO3 | B. | Cl2 | C. | HNO3 | D. | CO2 |
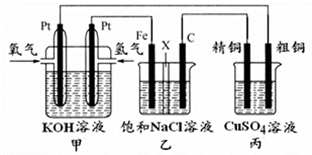 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.