��Ŀ����
��15�֣���ͬŨ�ȵ�������п��Ӧʱ��������Ա���ԭΪSO2��Ҳ�ɱ���ԭΪH2��Ϊ����֤��һ��ʵ��ijͬѧ������ͼ��ʾװ�ý���ʵ�飨ʵ��ʱѹǿΪ101 kPa���¶�Ϊ0 �棩��
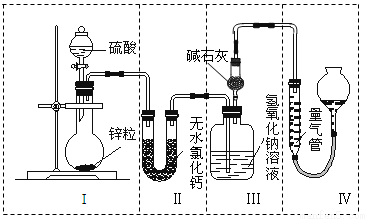
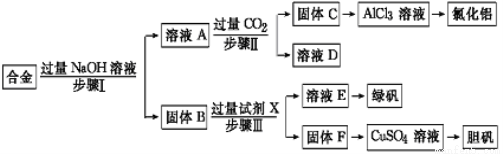
��1��������ƿ�з���0.65 gп������c mol��L��1��H2SO4��Ӧ��Ϊ��֤ʵ����۵Ŀɿ��������ܵ����˹���� ��
A��200 mL B��300 mL C��400 mL
��2����0.65gп����ȫ�ܽ⣬װ�â� ����0.64 g����Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3������ƿ��Ͷ��a gп����ȫ��Ӧ����������ϴ��ƿ����b g�����������ռ���V mL���壬���У�a g��65 g��mol��1��2��b g��64 g��mol��1��2+V mL��22400 mL��mol��1��2���õ�ʽ���ݵ�ԭ���� ��
��4��������ƿ��Ͷ��10gп������һ������18 mol��L��1Ũ����10 mL����ַ�Ӧ��п��ʣ�࣬���װ�â� ����3.2 g��������ʵ����̲����������У�m(SO2)/m(H2)= ��������װ�â���ʢ����ˮ�Ȼ��Ƶ�U�ιܣ�m(SO2) / m(H2)����ֵ�� ���ƫ����ƫС������Ӱ�족����
��1��B ��3�֣� ��2��Zn��2H2SO4(Ũ)��ZnSO4��SO2����2H2O��3�֣�
��3��ת�Ƶ����غ� ��3�֣� ��4��20��1 ��3�֣� ƫ��3�֣�
��������
�����������1��Zn+H2SO4��ZnSO4+H2��
1mol 22.4L
0.65g��65g/mol V
���V��0.224L��224ml����ѡB��
��2�����������Ǽ�������������壬��������ϴ��ƿ����˵���������������ɣ���п�����ᷴӦʱ��п����ԭ����������������������ԭΪ��������Zn+2H2SO4��Ũ����ZnSO4+SO2��+2H2O��
��3������������ԭ��Ӧ�е�ʧ����������г�ʽ�ӣ�
��4�����ӵ�������SO2�����������ʵ�����3.2g��64g/mol��0.05mol��Ũ��������ʵ�����0.18mol��
Zn+2H2SO4��Ũ����ZnSO4+SO2��+2H2O
2mol 1mol
0.1mol 0.05mol
������п��Ӧ��ϡ���ᷴӦ�����ʵ�����0.08mol
ʣ��п��������10g��0.05mol��65g/mol��6.75g
�����ʵ�����6.75g��65g/mol��0.1mol
����������������������0.08mol
�������ʵ����̲����������У�m(SO2)/m(H2)��0.05��64��0.08��2��20��1
������ʢ����ˮ�Ȼ��Ƶ�U�ܣ���������е�ˮ������������������Һ������ϴ��ƿ�������������Լ���ʱ������������ʵ�����������m(SO2) / m(H2)����ֵ��ƫ��
���㣺����п��Ũ���ᷴӦ���й��ж������

���и��������У�������������������������һ�������¾��ܷ�����Ӧ����
��� | �� | �� | �� |
A | Al | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SiO2 | NaOH | HF |
D | SO2 | Ca(OH)2 | NaHCO3 |
 ����
����