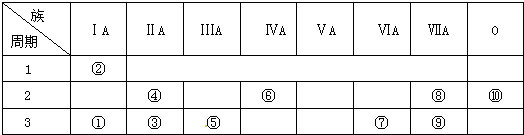
题目内容
向500mL NaOH溶液中投入10.8g Al,二者恰好完全反应后,则参加反应的NaOH的物质的量为 ;原NaOH溶液的物质的量浓度为 ;生成标准状况下H2的体积为 .
考点:化学方程式的有关计算
专题:计算题
分析:发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据n=
计算Al的物质的量,根据方程式计算NaOH、氢气的物质的量,根据c=
计算其物质的量浓度,根据V=n?Vm计算氢气的体积.
| m |
| M |
| n |
| V |
解答:
解:10.8gAl的物质的量=
=0.4mol,
答:10.8gAl的物质的量为0.4mol.
(2)令参加反应的NaOH的物质的量为x mol、生成氢气的物质的量为y mol,则:
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
2 2 3
0.4mol xmol ymol
所以,2:2=0.4mol:x mol,解得x=0.4
2:3=0.4mol:y mol,解得y=0.6
故NaOH溶液的物质的量浓度=
=0.8mol/L,
标况下,生成氢气的体积为:0.6mol×22.4L/mol=13.44L
故答案为:0.4mol; 0.8mol/L; 13.44L.
| 10.8g |
| 27g/mol |
答:10.8gAl的物质的量为0.4mol.
(2)令参加反应的NaOH的物质的量为x mol、生成氢气的物质的量为y mol,则:
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
2 2 3
0.4mol xmol ymol
所以,2:2=0.4mol:x mol,解得x=0.4
2:3=0.4mol:y mol,解得y=0.6
故NaOH溶液的物质的量浓度=
| 0.4mol |
| 0.5L |
标况下,生成氢气的体积为:0.6mol×22.4L/mol=13.44L
故答案为:0.4mol; 0.8mol/L; 13.44L.
点评:本题考查化学方程式的有关计算,比较基础,侧重对基础知识的巩固,注意对基础知识理解掌握.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、凡能发生银镜反应的有机物一定是醛 |
| B、酸和醇发生的反应一定是酯化反应 |
| C、乙醇易溶于水是因为分子间形成了一种叫氢键的化学键 |
| D、在酯化反应中,羧酸脱去羧基中的羟基,醇脱去羟基中的氢而生成水和酯 |
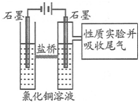 利用如图装置作电解50mL 0.5mol/L的CuCl2溶液实验.
利用如图装置作电解50mL 0.5mol/L的CuCl2溶液实验.