题目内容
2.福酚美克是一种影响机体免疫力功能的药物,可通过以下方式合成:
(1)A中的含氧官能团有羟基和酯基.
(2)E→F的反应类型为取代.
(3)设计A→B转化的目的是防止羟基被氧化.
(4)已知C→D的反应为氧化反应,C的分子式是C10H12O4,则该反应的化学方程式为
 .
.(5)写出同时满足下列条件的A的一种同分异构体的结构简式:
 或
或 .
.Ⅰ.不能发生银镜反应
Ⅱ.不能与FeCl3溶液发生显色反应,但水解能与FeCl3溶液发生显色反应
Ⅲ.分子有中4种不同化学环境的氢
(6)根据已有知识并结合相关信息,写出以苯乙醇为
 原料制备
原料制备
的合成路线流程图(无机试剂任用).
分析 (1)根据A的结构可知A中的含氧官能团;
(2)比较E和F的结构简式可知,E中两个醚键被氢原子取代后生成两个羟基;
(3)A→B中将两个羟基生成两醚键,E→F中又生成两个羟基,主要防止在C到D的转化中酚羟基被氧化;
(4)已知C→D的反应为醇的催化氧化,根据原子守恒可写出此反应的化学方程式;
(5)A的同分异构体具备的条件是:Ⅰ.不能发生银镜反应,说明不含有醛基;
Ⅱ.不能与FeCl3溶液发生显色反应,说明不含有酚羟基,但水解能与FeCl3溶液发生显色反应,说明含有羧酸苯酯基团;
Ⅲ.分子有中4种不同化学环境的氢,说明结构相对对称;
(6)以苯乙醇为 原料制备
原料制备 ,可以将苯乙醇先氧化得到苯乙醛,再用苯乙醛发生信息反应与NaCN、NH3发生加成反应,加成产物再酸性下水解,最后分子间形成脱水形成肽键即可得到目标产物.
,可以将苯乙醇先氧化得到苯乙醛,再用苯乙醛发生信息反应与NaCN、NH3发生加成反应,加成产物再酸性下水解,最后分子间形成脱水形成肽键即可得到目标产物.
解答 解:(1)有机物A的结构简式为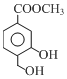 ,含有的官能团为羟基和酯基,故答案为:羟基、酯基;
,含有的官能团为羟基和酯基,故答案为:羟基、酯基;
(2)由E→F的反应类型为取代反应,故答案为:取代;
(3)羟基易被氧化,设计A→B过程可避免C→D过程中被CrO3氧化,故答案为:防止羟基被氧化;
(4)C→D过程中用CrO3作氧化剂发生的反应方程式为 ,故答案为:
,故答案为: ;
;
(5)Ⅰ.不能发生银镜反应,说明不含有醛基;Ⅱ.不能与FeCl3溶液发生显色反应,说明不含有酚羟基,但水解能与FeCl3溶液发生显色反应,说明含有羧酸苯酯基团;Ⅲ.分子有中4种不同化学环境的氢,说明结构相对对称;同时满足上述条件的A的同分异构体有 或
或 ,故答案为:
,故答案为: 或
或 ;
;
(6)以苯乙醇为 原料制备
原料制备 ,可以将苯乙醇先氧化得到苯乙醛,再用苯乙醛发生信息反应与NaCN、NH3发生加成反应,加成产物再酸性下水解,最后分子间形成脱水形成肽键即可得到目标产物,具体流程为:
,可以将苯乙醇先氧化得到苯乙醛,再用苯乙醛发生信息反应与NaCN、NH3发生加成反应,加成产物再酸性下水解,最后分子间形成脱水形成肽键即可得到目标产物,具体流程为: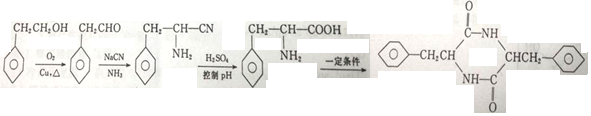 ;故答案为:
;故答案为: .
.
点评 考查有机推断与合成,是高频考点,综合性强,难度大,要求学生要扎实的基础,难点是按要求设计合成路线,灵活利用题中信息是解题关键.

 金属钒(V)广泛应用于航空、化工、能源等行业.
金属钒(V)广泛应用于航空、化工、能源等行业.(1)钒元素基态原子的电子排布式为1s22s22p63s23p63d34s2{或[Ar]3d34s2},3d能级上的未成对电子数为3.
(2)VCl2溶液与乙二胺(H2N-CH2-CH3-NH4)可形成配离子[V(En)2]2+(En是乙二胺的简写),该配离子中所含非金属元素的电负性由大到小的顺序是N>C>H(用元素符号表示).乙二胺分子中氮原子的杂化轨道类型为sp3,乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键.
(3)LiVH4是一种特殊的还原剂,可将乙酸直接还原成乙醇.CH3COOH和CH3CH2OH分子中σ键数目之比为7:8.
(4)钒能形成多种配合物,钒的两种配合物X、Y的化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来).
| X | X | Y | Y | |
| 试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
| 现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
(5)VO晶体的晶胞结构如图所示,VO晶体中V2+的配位数为6.若该晶胞边长为b nm,则该晶体的密度为$\frac{4×67}{(b×1{0}^{-7})^{3}×{N}_{A}}$(用含b,NA的代数式表示)g•cm-3.

| A. | 装置A的作用是除去氯气中的水蒸气 | |
| B. | 该实验必须在通风橱中进行 | |
| C. | 装置C中发生的反应为Cl2+2NaOH═NaCl+NaClO+H2O | |
| D. | 装置B的现象是干燥处布条褪色,湿润处布条不褪色 |
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | 乙醇 (乙酸) | CaO | 蒸馏 |
| B | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | CH3CH2Br(Br2) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙烯在一定条件下与水反应 | |
| B. | 在光照条件下,甲烷与氯气的反应 | |
| C. | 在一定条件下,苯与氯气的反应 | |
| D. | 乙烯通入溴的四氯化碳溶液中的反应 |
| A. | 锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 碳酸氢钠溶液加入少量石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 铜与稀硝酸反应制取一氧化氮:Cu+4H++2NO3-=Cu2++2NO↑+2H2O | |
| D. | 在硝酸亚铁溶液中滴加盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
(1)甲同学认为,反应产生的I2溶于水见黄色;乙同学认为,Fe2+被氧化成Fe3+使溶液变成黄色;丙同学认为,溶液的黄色是I2和Fe3+共同引起的;
(2)现提供备选试剂:A.酸性高锰酸钾溶液 B.氢氧化纳溶液
C.四氯化碳 D.硫氯化钾溶液
为验证各自的猜想是否正确,甲乙两同学各取少量反应后的溶液,选择以上所提供的备选试剂,设计实验方案进行探究:
| 选用试剂 | 预期的实验现象 | |
| 甲同学的方案 | ||
| 乙同学的方案 |
(4)根据上述实验推测,若在碘化亚铁溶液中通入少量氯气,则首先被氧化的离子是I-(填粒子的化学式);若在碘化亚铁溶液中通入过量氯气,则相应的离子方程式为2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-.



