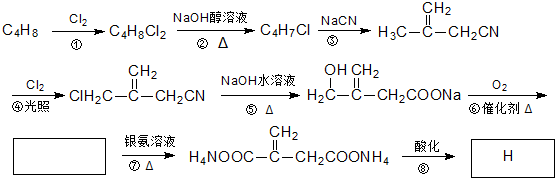
题目内容
乙炔不但是重要的化工原料,而且广泛用于气焊、气割.
已知:CH4(g)+2O2 (g)═CO2(g)+2H2O(l)△H=+-890kJ?mol-1 .
2H2 (g)+O2 (g)═2H2O(l)△H=-571.6kJ?mol-1.
2C2H2(g)+5O2 (g)═4CO2 (g)+2H2O (l)△H=-2600kJ?mol-1.
(1)甲烷裂解生成乙炔的热化学方程式可表示为 ;
(2)电石法被淘汰可能原因是 ;
(3)甲烷裂解制乙炔,已知对于气相反应,用某组分(B)的压强(pB)代替物质的量弄苏(cB)也可表示平衡常数(记作KB),则反应的KB= .
已知:CH4(g)+2O2 (g)═CO2(g)+2H2O(l)△H=+-890kJ?mol-1 .
2H2 (g)+O2 (g)═2H2O(l)△H=-571.6kJ?mol-1.
2C2H2(g)+5O2 (g)═4CO2 (g)+2H2O (l)△H=-2600kJ?mol-1.
(1)甲烷裂解生成乙炔的热化学方程式可表示为
(2)电石法被淘汰可能原因是
(3)甲烷裂解制乙炔,已知对于气相反应,用某组分(B)的压强(pB)代替物质的量弄苏(cB)也可表示平衡常数(记作KB),则反应的KB=
考点:用盖斯定律进行有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:(1)根据盖斯定律来分析;
(2)电石与水反应很剧烈,难以控制;
(3)将化学平衡常数中的浓度c换成压强P就可以得到KB;
(2)电石与水反应很剧烈,难以控制;
(3)将化学平衡常数中的浓度c换成压强P就可以得到KB;
解答:
解:(1)已知:①CH4(g)+2O2 (g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1 .
②2H2 (g)+O2 (g)═2H2O(l)△H=-571.6kJ?mol-1.
③2C2H2(g)+5O2 (g)═4CO2 (g)+2H2O (l)△H=-2600kJ?mol-1.
将①×4-③-②×3可得:2CH4(g)=C2H2(g)+3H2 (g)△H=(-890kJ?mol-1 )×4-(-2600kJ?mol-1)-(-571.6kJ?mol-1)×3=+754.8KJ/mol
故答案为:2CH4(g)=C2H2(g)+3H2 (g)△H=+754.8KJ/mol;
(2)电石与水反应很剧烈,难以控制,故答案为:电石与水反应很剧烈,难以控制;
(3)2CH4(g)=C2H2(g)+3H2 (g),对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作KB),反应的平衡常数KB=
;故答案为:
;
②2H2 (g)+O2 (g)═2H2O(l)△H=-571.6kJ?mol-1.
③2C2H2(g)+5O2 (g)═4CO2 (g)+2H2O (l)△H=-2600kJ?mol-1.
将①×4-③-②×3可得:2CH4(g)=C2H2(g)+3H2 (g)△H=(-890kJ?mol-1 )×4-(-2600kJ?mol-1)-(-571.6kJ?mol-1)×3=+754.8KJ/mol
故答案为:2CH4(g)=C2H2(g)+3H2 (g)△H=+754.8KJ/mol;
(2)电石与水反应很剧烈,难以控制,故答案为:电石与水反应很剧烈,难以控制;
(3)2CH4(g)=C2H2(g)+3H2 (g),对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作KB),反应的平衡常数KB=
| P(C2H2)P3(H2) |
| P2(CH4) |
| P(C2H2)P3(H2) |
| P2(CH4) |
点评:本题考查了盖斯定律的运用和平衡常数的计算,均属于高频考点,难度不大.

练习册系列答案
相关题目
在下列分类中,前者包含后者的是( )
| A、物质的量、摩尔质量 |
| B、置换反应、氧化还原反应 |
| C、化合物、电解质 |
| D、胶体、分散系 |
下表是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和是2l.下列说法不正确的是( )
| X | Y | ||
| Z | W |
| A、原子半径Z>W>Y |
| B、最高价氧化物对应水化物的酸性Z>W |
| C、氢化物的稳定性X>Z |
| D、X的氢化物与Y的氢化物能发生化合反应生成离子化合物 |
下列比较中,正确的是( )
| A、原子半径:Na>Mg |
| B、碱性:NaOH>KOH |
| C、结合H+的能力:CO32-<Cl- |
| D、还原性:I-<Br- |
某一容器中发生如下反应:2NO(g)+O2(g)═2NO2(g);△H=Q kJ?mol-1在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的关系如图所示.下列判断正确的是( )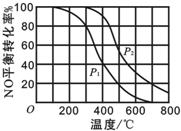

| A、p2>p1且Q<0 |
| B、p2>p1且Q>0 |
| C、p2<p1且Q<0 |
| D、p2<p1且Q>0 |
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.

下列分析不正确的是( )

下列分析不正确的是( )
| A、0~4分钟时,A的速率为0.01mol/(L?min) | ||
| B、由T1向T2变化时,V正>V | ||
C、该反应的平衡常数表达式K=
| ||
| D、此反应的正反应为吸热反应. |
下列物质中的杂质(括号内为杂质),不能用在空气中加热的方法除去的是( )
| A、Na2O2(Na2O) |
| B、KCl(KClO3) |
| C、Na2CO3(NaHCO3) |
| D、NH4Cl(I2) |