题目内容
15.已知Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0,则下列关于该反应的叙述不正确的是( )| A. | 该反应中旧键断裂需吸收能量小于新键形成需放出能量 | |
| B. | 上述热化学方程式中的△H的值与反应物的用量无关 | |
| C. | 该反应的化学能可以转化为电能 | |
| D. | 反应物的总能量高于生成物的总能量 |
分析 A、旧键断裂需吸收能量,新键形成需放出能量;
B、依据焓变概念分析判断,△H=H(生成物总焓)-H(反应物总焓);
C、反应是自发进行的氧化还原反应,可以设计成原电池实现化学能转化为电能;
D、反应时放热反应,依据能量守恒分析,反应物能量高于生成物.
解答 解答:解:A、断裂化学键吸收能量,生成化学键会放热,因为△H<0未放热反应,所以旧键断裂需吸收能量小于新键形成需放出能量,故A正确;
B、作为一个描述系统状态的状态函数,焓变没有明确的物理意义,△H(焓变)表示的是系统发生一个过程的焓的增量,确定了一个化学方程式,就确定了一个焓变,焓变并不随反应物的增加而增加,焓变与化学方程式的写法有关,故B错误;
C、反应是氧化还原反应,可以设计成原电池,锌做负极,失电子,溶液中氢离子在正极得到电子实现化学能转化为电能,故C正确;
D、反应是放热反应,依据能量守恒,反应物总能量大于生成物总能量,故D正确;
故选B.
点评 本题考查了焓变的含义理解,原电池的原理分析,化学反应能量变化和能量守恒关系,化学键变化与能量变化判断,题目较简单.

练习册系列答案
相关题目
5.200mL硝酸与一定量的铝镁铁合金反应生成3.36L NO(标准状况)和铁盐、铝盐、镁盐等,再向反应后的溶液中加入150mL 3mol•L-1的NaOH溶液,使铝镁铁元素恰好全部转化为沉淀,则原硝酸的浓度是( )
| A. | 1.5 mol•L-1 | B. | 2.25 mol•L-1 | C. | 3 mol•L-1 | D. | 无法计算 |
20.下列贮存化学试剂的方法正确的是( )
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 用做感光片的溴化银贮存在无色试剂瓶中 | |
| C. | 烧碱溶液放在带磨口玻璃塞的试剂瓶中 | |
| D. | 1mol/L NaCl溶液不能长期保存在容量瓶中 |
 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
 实验室配制500mL0.1mol•Lˉ1Na2CO3溶液,回答下列问题:
实验室配制500mL0.1mol•Lˉ1Na2CO3溶液,回答下列问题: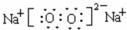 .
.


 .
.