题目内容
3.用30g乙酸和40g乙醇反应,如果实验产率是理论产率的85%,可以得到多少克乙酸乙酯?分析 反应的方程式为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,根据乙酸和乙醇的质量关系判断反应的过量问题,根据不足量的物质计算乙酸乙酯的理论产量,结合产率计算乙酸乙酯的实际产量.
解答 解:30g乙酸的物质的量为$\frac{30g}{60g/mol}$=0.5mol,40g乙醇的物质的量为$\frac{40g}{46g/mol}$mol=0.87mol,根据反应方程式CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,可知乙醇过量,
设乙酸乙酯的理论产量为m,则
CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
60 88
30g m
故m=$\frac{30g×88}{60}$=44g
故可以得到CH3COOCH2CH3为44g×85%=37.4g,
答:可以得到37.4g乙酸乙酯.
点评 本题考查化学方程式的计算,涉及过量计算问题、产率有关计算,侧重对基础知识的巩固,比较基础.

练习册系列答案
相关题目
13.下列化学用语表示正确的是( )
| A. | 乙烯的最简式:CH2═CH2 | |
| B. | Cl-的离子结构示意图: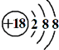 | |
| C. | 二氧化碳的电子式: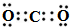 | |
| D. | 原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl |
14.25℃、101kPa 下:
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511KJ/mol
下列说法正确的是( )
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511KJ/mol
下列说法正确的是( )
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101kPa 下,Na2O2(s)+2 Na(s)═2Na2O(s)△H=-317kJ/mol |
11.某有机物分子的结构简式如图所示:下列相关叙述正确的是( )
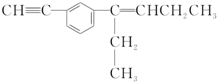

| A. | 该有机化合物含有3种官能团 | |
| B. | 该有机物分子中最多有12个碳原子在同一平面内 | |
| C. | 该有机物分子中最多有6个碳原子共线 | |
| D. | 该有机物分子中最多有14个碳原子在同一平面内 |
18.已知短周期元素的离子aA3+、bB+、cC2-、dD- 都具有相同的电子层结构,判断下列关系正确的是( )
| A. | 原子序数:a>b>d>c | B. | 原子半径:A>B>C>D | ||
| C. | 离子的还原性:D->C2- | D. | 气态氢化物的稳定性:H2C>HD |
8.双缩脲法测定禾谷类作物样品中的蛋白质含量时,加入少量的四氯化碳(CCl4)其主要作用是( )
| A. | 促进双缩脲反应 | B. | 消除色素类对比色的干扰 | ||
| C. | 促进难溶性物质沉淀 | D. | 保持反应物颜色的稳定 |
10.下列说法中不正确的是( )
| A. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 | |
| B. | 开发核能、太阳能等新能源,推广乙醇汽油等可直接降低碳排放 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 石油主要是各种烷烃、环烷烃、烯烃组成的混合物 |
11.下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| B. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数必然相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 同温同压下,等体积的物质所含的分子数一定相等 |