题目内容
9.由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下: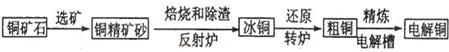
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物.
①该过程中两个主要反应的化学方程式分别是2CuFeS2+O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S+2FeS+SO2、FeS+3O2$\frac{\underline{\;高温\;}}{\;}$2FeO+2SO2;
②反射炉内生成炉渣的主要成分是FeSiO3.
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O.生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜.
该过程发生反应的化学方程式分别是2Cu2S+3O2 $\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2、2Cu2O+Cu2S$\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑.
(3)粗铜的电解精炼如图所示.
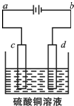
①在粗铜的电解过程中,粗铜板应是图中电极c(填图中的字母);
②在电极d上发生的电极反应式为Cu2++2e-=Cu;
③若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为Au、Ag以单质形式沉积在阳极下方,Fe以Fe2+形式进入电解液中.
分析 (1)黄铜矿与空气反应生成Cu和Fe的低价硫化物:产物为Cu2S、FeS;部分Fe的硫化物转变为Fe的低价氧化物:产物为FeO;反射炉内生成炉渣的主要成分是FeSiO3;
(2)Cu2S被氧化为Cu2O:2Cu2S+3O2 $\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S $\frac{\underline{\;高温\;}}{\;}$6Cu+2SO2↑;
(3)粗铜应该放在阳极,c是阳极;d是阴极,发生还原反应 Cu2++2e-=Cu;粗铜中的Au、Ag、,它们在电解槽中的下方,以单质形式沉积在c(阳极)下方;Fe以Fe2+的形式进入电解液中.
解答 解:(1)①黄铜矿与空气反应生成Cu2S、FeS,根据化合价升降相等配平,反应方程式为:2CuFeS2+O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2 $\frac{\underline{\;高温\;}}{\;}$2FeO+2SO2,故答案是:2CuFeS2+O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S+2FeS+SO2;FeS+3O2$\frac{\underline{\;高温\;}}{\;}$2FeO+2SO2;
②生成炉渣的主要成分为:FeSiO3,故答案为:FeSiO3;
(2)Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2 $\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2;Cu2O与Cu2S发生反应的方程式为:2Cu2O+Cu2S $\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑,
故答案是:2Cu2S+3O2 $\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2;2Cu2O+Cu2S $\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑;
(3)①c连电源正极,d连电源的负极;故c为阳极,d为阴极,故答案为:c;
②粗铜板应放在阳极,即c;d阴极发生还原反应,方程式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
③Au、Ag比较稳定,不反应,以单质形式沉积在c(阳极)下方,Fe失去电子变成Fe2+的形式进入电解液中,
故答案是:Au、Ag以单质形式沉积在阳极下方,Fe以Fe2+形式进入电解液中.
点评 本题考查综合考查铜及其化合物的性质、电解精炼铜的工作原理,为高频考点,侧重考查了学生阅读信息、处理信息的能力,难度稍大.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案| A. | 加水稀释,平衡左移,溶液颜色变浅 | |
| B. | 加入一定量的NaOH溶液,有红褐色沉淀产生,溶液颜色变浅 | |
| C. | 加入一定量的铁粉,充分振荡后,溶液颜色变浅 | |
| D. | 加入少量的KCl固体,平衡左移,溶液颜色变浅 |
| 选项 | 实验 | 方法(或操作) | 原理 |
| A | 分离溶于水中的溴 | 裂解汽油萃取 | 碘在裂解汽油中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 从蛋清中提取蛋白质 | 加入硫酸铜溶液 | 浓盐溶液使蛋白质溶解度降低 |
| D | 尿液中尿糖的检验 | 加入新制Cu(OH)2、加热 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 质子数是2 | B. | 质量数是1 | C. | 电子数是3 | D. | 中子数是2 |
| A. | 钠与水反应 | B. | 液氨气化 | ||
| C. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | D. | 碳酸钙分解 |
| A. | 原子半径:m>n | B. | 氢化物的稳定性:n>p | ||
| C. | q的最高价氧化物的水化物为强酸 | D. | n在自然界中能以游离态存在 |
| A. | pH=3的醋酸溶液稀释100倍后,溶液的pH=5 | |
| B. | pH=2的盐酸与等体积0.01 mol?L-1醋酸钠混合溶液后,溶液中c(Cl-)=c(CH3COO-) | |
| C. | 氨水中通入过量CO2后,溶液中c(H+)+c(NH4+)=c(OH-)+c(HCO3-) | |
| D. | 0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)>c(I-) |