题目内容
18.下表是不同温度下水的离子积数据:| 温度/℃ | 25 | t 1 | t 2 |
| 水的离子积 KW | 1×10-14 | 1×10-13 | 1×10-12 |
(1)25℃下,某 Na2SO4 溶液中 c(SO42-)=5×10-4mol?L-1,取该溶液 1mL 加水稀释至10mL,则稀释后溶液中 c(Na+):c(OH-)=1000:1.
(2)在 t 2℃下,将 a mol?L-1CH3COOH 溶液与 b mol?L-1NaOH 溶液等体积混合反应后,溶液恰好呈中性,则该温度下 CH3COOH 的电离常数 Ka=$\frac{b×1{0}^{-6}}{a-b}$(用 a、b 表示).
分析 (1)硫酸钠溶液是显中性的,根据硫酸钠的化学式组成判断c(Na+):c(SO42- )=2:1;根据常温下氢离子浓度计算c(Na+):c(OH-);
(2)t2水的离子积常数为1×10-12,混合液呈中性,c(H+)=c(OH-)=10-6mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,然后结合醋酸的电离平衡常数表达式进行计算.
解答 解:(1)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,故答案为:1000:1;
(2)t2水的离子积常数为1×10-12,混合液呈中性,c(H+)=c(OH-)=10-6mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,醋酸的电离平衡常数Ka=$\frac{[C{H}_{3}CO{O}^{-}][{H}^{+}]}{[C{H}_{3}COOH]}$=
$\frac{0.5b×1{0}^{-6}}{0.5a-0.5b}$=$\frac{b×1{0}^{-6}}{a-b}$,故答案为:$\frac{b×1{0}^{-6}}{a-b}$.
点评 本题考查了水的电离、溶液pH、离子积常数的简单计算,题目难度不大,本题是基础性知识的考查,主要是巩固学生对教材基础知识的理解掌握程度,提高学生的解题能力

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.当今世界面临日益加剧的能源危机,下列关于能源的描述不正确的是( )
| A. | 提高燃料的利用效率是解决能源危机的方向 | |
| B. | 正在探索的新能源有太阳能、氢能、风能、海洋能和生物质能等 | |
| C. | 新能源的优点是可以再生、没有污染或者很少污染 | |
| D. | 燃烧热是评价燃料优劣的唯一标准 |
9.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 在标准状况下,2.24 L H2O中含有0.1 NA个水分子 | |
| B. | 0.1mol/LNaCl溶液中含有Na+个数为0.1NA | |
| C. | 1molFe与足量盐酸完全反应,Fe失去的电子数为3NA | |
| D. | 在标准状况下,1gH2含有的原子数为NA |
10.通常情况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( )
| A. | 分子中键角小于109.5.是因为氮原子轨道杂化类型为sp2杂化 | |
| B. | 分子中的所有原子均达到8电子稳定结构 | |
| C. | NCl3分子是非极性分子 | |
| D. | NBr3 比NCl3易挥发 |
7.下列说法正确的是( )
| A. | 活化分子间所发生的碰撞为有效碰撞 | |
| B. | 由C(s,石墨)=C(s,金刚石)△H>0可知,金刚石比石墨稳定 | |
| C. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | 有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
9.下列关于氨气的说法正确的是( )
| A. | 氨气既能用浓硫酸干燥也能用无水CaCl2干燥 | |
| B. | NH3是电解质,所以氨水能导电 | |
| C. | 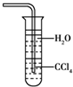 用水吸收NH3用如图装置可防止倒吸 | |
| D. | NH3可以使干燥的红色石蕊试纸变蓝 |
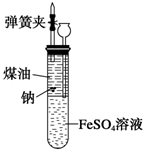 有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入用煮过的蒸馏水配制的FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图).仔细观察,回答下列问题:
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入用煮过的蒸馏水配制的FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图).仔细观察,回答下列问题: 工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.