题目内容
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17.
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液)S(AgX)、S(AgY)、S(AgZ)的大小顺序为 .
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-) (填“增大”“减小”或“不变”).
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为 .
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液)S(AgX)、S(AgY)、S(AgZ)的大小顺序为
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:(1)结构相似的难溶性盐,溶度积越小,溶解度越小;
(2)AgY溶的溶度积比AgX小,从沉淀平衡移动的角度分析;
(3)0.188g的AgY(相对分子质量188)固体放入100mL水中,固体不能全部溶解.
(2)AgY溶的溶度积比AgX小,从沉淀平衡移动的角度分析;
(3)0.188g的AgY(相对分子质量188)固体放入100mL水中,固体不能全部溶解.
解答:
解:(1)根据化学式相似的物质的溶度积常数越小,物质越难溶,溶解度越小,可知三者溶解度(mol/L)的大小顺序为S(AgX)>S(AgY)>S(AgZ),
故答案为:S(AgX)>S(AgY)>S(AgZ);
(2)AgX比AgY溶解度大,所以AgX饱和溶液中c(Ag+)较大,若向AgY的饱和溶液中加入少量AgX的固体,则c(Ag+)增大,AgY的沉淀溶解平衡逆移,所以c(Y-)将减小,故答案为:减小;
(3)0.188g的AgY(相对分子质量188)固体放入100mL水中,固体不能全部溶解,已知Ksp(AgY)=1.0×10-12,所以在25℃时饱和AgY溶液的浓度为c(AgY)=c(Ag+)=c(Y-)=
=1×10-6mol?L-1,故答案为:1×10-6 mol?L-1.
故答案为:S(AgX)>S(AgY)>S(AgZ);
(2)AgX比AgY溶解度大,所以AgX饱和溶液中c(Ag+)较大,若向AgY的饱和溶液中加入少量AgX的固体,则c(Ag+)增大,AgY的沉淀溶解平衡逆移,所以c(Y-)将减小,故答案为:减小;
(3)0.188g的AgY(相对分子质量188)固体放入100mL水中,固体不能全部溶解,已知Ksp(AgY)=1.0×10-12,所以在25℃时饱和AgY溶液的浓度为c(AgY)=c(Ag+)=c(Y-)=
| 1.0×10-12 |
点评:本题考查难溶电解质的溶解平衡及沉淀转化的本质,题目难度中等,本题注意溶度积常数的利用和理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
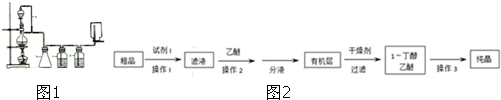
下列关于有机物的认识正确的是( )
| A、C2H6与氯气发生取代反应、C2H4与HCl发生加成反应均可得到纯净的C2H5Cl |
| B、将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 |
| C、乙烯结构中含有碳碳双键,苯中不含有碳碳双键,但两者均可以发生加成反应 |
| D、苯使酸性KMn04溶液、溴水都褪色,发生的都是氧化反应 |
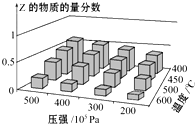 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A、△H>0 a+b>c |
| B、△H<0 a+b<c |
| C、△H<0 a+b>c |
| D、△H>0 a+b<c |
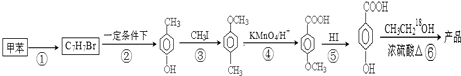
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )


| A、②④ | B、①②③ |
| C、①③④ | D、①②③④ |
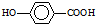 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 的同分异构体很多,其中符合下列条件有
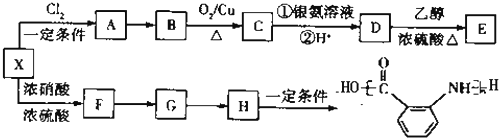
的同分异构体很多,其中符合下列条件有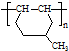 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:
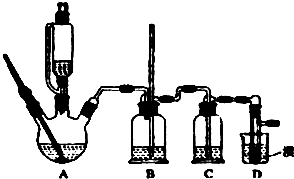 实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH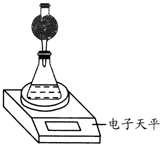 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol?L-1 HNO3、2.00mol?L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol?L-1 HNO3、2.00mol?L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.