题目内容
7.已知在标准状况下,某气体的体积为33.6L,气体的物质的量是1.5mol,若是CO2气体,则该气体的质量是66g,若是CO和CO2气体总中质量为58克,其中氧原子个数是2.5 NA,混合气体中碳氧原子个数比为3:5.分析 根据n=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$、N=nNA,结合分子的组成进行计算;.
解答 解:已知在标准状况下,某气体的体积为33.6L,气体的物质的量是$\frac{33.6L}{22.4L/mol}$=1.5mol;若是CO2气体,则该气体的质量是m=nM=1.5mol×44g/mol=66g;
若是CO和CO2气体总中质量为58克,设为CO为xmol,CO2为ymol,
则$\left\{\begin{array}{l}{x+y=1.5mol}\\{28x+44y=58g}\end{array}\right.$,解得:x=0.5mol,y=1mol,则氧原子个数是(0.5mol+2mol)NA=2.5NA,混合气体中碳氧原子个数比为(0.5+1):(0.5+2)=3:5;
故答案为:1.5mol;66g;2.5NA;3:5.
点评 本题考查了物质的量的有关计算,明确各个物理量之间的关系是解本题关键,根据公式来分析解答即可,难度不大,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
15.现有①硫酸镁 ②硝酸钡 ③氢氧化钠 ④氯化铜 ⑤氯化钾 五种溶液,不用任何其他试剂也可鉴别,且鉴别出来的先后顺序正确的是( )
| A. | ④③①②⑤ | B. | ④⑤③②① | C. | ④③②①⑤ | D. | ④②③①⑤ |
2.用锌,氧化铜,稀硫酸作原料制取铜时,有下列两种途径:
(1)锌$\stackrel{稀硫酸}{→}$ 氢气$\stackrel{氧化铜}{→}$ 铜
(2)氧化铜$\stackrel{稀硫酸}{→}$ 硫酸铜 $\stackrel{锌铜}{→}$
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
(1)锌$\stackrel{稀硫酸}{→}$ 氢气$\stackrel{氧化铜}{→}$ 铜
(2)氧化铜$\stackrel{稀硫酸}{→}$ 硫酸铜 $\stackrel{锌铜}{→}$
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
| A. | 消耗相同质量的硫酸 | B. | 消耗相同质量的锌 | ||
| C. | 消耗相同质量的氧化铜 | D. | 生成的硫酸锌质量相同 |
12.下列反应的离子方程式正确的是( )
| A. | 铜放入稀硫酸中:Cu+2H+═Cu2++H2↑ | |
| B. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 金属铁溶于稀硫酸中:2Fe+6 H+═2 Fe3++3 H2↑ | |
| D. | 向硫酸溶液中加入氢氧化钡溶液:SO42++Ba2+═BaSO4↓ |
19.下列反应不能通过一步反应实现的是( )
| A. | Fe→FeCl3 | B. | SiO2→Na2SiO3 | C. | Al2O3→Al(OH)3 | D. | NaO→Na2SO4 |
16.以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如图:

已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(2)本流程中产生的CO2和H2,在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为HCOOH(l)+$\frac{1}{2}$O2(g)═CO2(g)+H2O(g);△H=-254.6kJ/m.
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4•FeSO4•6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
KMnO4溶液应盛装在酸式滴定管中,滴定过程中发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O滴定终点的现象是最后一滴滴入,溶液由无色变为浅紫色,且30s不变色通过实验数据计算的该产品纯度为$\frac{980c}{a}×100%$(用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是BC
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.

已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(2)本流程中产生的CO2和H2,在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为HCOOH(l)+$\frac{1}{2}$O2(g)═CO2(g)+H2O(g);△H=-254.6kJ/m.
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4•FeSO4•6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
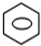 +HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$
+HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$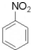 +H2O.
+H2O.
 ,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.
,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.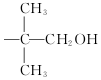 基团;
基团;