��Ŀ����
����Ŀ�����������գ���������(NaBH4)�Ǻϳ��г��õĻ�ԭ��������NaBO2Ϊ��Ҫԭ���Ʊ�NaBH4(BԪ�ػ��ϼ�Ϊ+3)�ķ�ӦΪ��NaBO2+SiO2+Na+H2![]() NaBH4+Na2SiO3(δ��ƽ)���������׳��ݻ������ˮ�������ڹ�ҵ������Ҳ�й㷺Ӧ��(��֪����Ϊ����������)
NaBH4+Na2SiO3(δ��ƽ)���������׳��ݻ������ˮ�������ڹ�ҵ������Ҳ�й㷺Ӧ��(��֪����Ϊ����������)
���������գ�
(1)������Ӧ�У�ԭ�������������δ�ɶԵ��ӵ�Ԫ����_____(��Ԫ�ط���)��SiO2�۵�ߵ�ԭ����_____��
(2)������Ӧ��H2��Na�����ʵ���֮��Ϊ_____��
(3)������ˮ��Һ��������(H2SiO3)��Ӳ��ճ�ᣬ���м��ԣ���ԭ����_____(�����ӷ���ʽ��ʾ)�����칤���п����Ȼ����Ϊˮ������Ӳ����������ƽ��ԭ�����Խ���_____��
(4)NaBH4��ʹ����������ӻ�ԭ�ɽ������ʡ��������Ӻ�������(Au3+)�ķ�Һ����ȡAu����ƽ�÷�Ӧ�����ӷ���ʽ��_____Au3++_____BH4��+_____OH-��_____Au+_____BO2��+_____H2O��
(5)�����о�������NaBH4��H2O2Ϊԭ�ϣ�NaOH��Һ���������Һ��������Ƴ�ȫҺ����أ���ÿ����1L6mol/L H2O2��Һ��������������·�еĵ�����Ϊ_____��
���𰸡�O��Si ���������γɵ���ԭ�Ӿ��� 1��2 ![]() +2H2OH2SiO3+2OH�� �����ƺ��Ȼ�臨���˫ˮ����ٽ����ɸ���������Ӳ�� 8 3 24 8 3 18 12NA
+2H2OH2SiO3+2OH�� �����ƺ��Ȼ�臨���˫ˮ����ٽ����ɸ���������Ӳ�� 8 3 24 8 3 18 12NA
��������
д��NaBO2+SiO2+Na+H2![]() NaBH4+Na2SiO3��ԭ��������������Ų���Ȼ������жϣ�����������ԭ�ӹ��ɵ�ԭ�Ӿ��壬�ݴ˷����жϣ���ƽ��ѧ����ʽ�õ����ʵĶ�����ϵ����������ǿ�������Σ���������ӷֲ�ˮ�⣬��Һ�Լ��ԣ����ù������笠�����˫ˮ����������õ���غ㡢�����غ㶨������ƽ���ӷ�Ӧ����ʽ���ڵ�ط�Ӧ�У�ÿ����1L 6mol/L H2O2��Һ������˫��ˮ�����ʵ���Ϊ6mol������֪H2O2+2e����2OH��������������������·�еĵ�������
NaBH4+Na2SiO3��ԭ��������������Ų���Ȼ������жϣ�����������ԭ�ӹ��ɵ�ԭ�Ӿ��壬�ݴ˷����жϣ���ƽ��ѧ����ʽ�õ����ʵĶ�����ϵ����������ǿ�������Σ���������ӷֲ�ˮ�⣬��Һ�Լ��ԣ����ù������笠�����˫ˮ����������õ���غ㡢�����غ㶨������ƽ���ӷ�Ӧ����ʽ���ڵ�ط�Ӧ�У�ÿ����1L 6mol/L H2O2��Һ������˫��ˮ�����ʵ���Ϊ6mol������֪H2O2+2e����2OH��������������������·�еĵ�������
(1)NaBO2+SiO2+Na+H2![]() NaBH4+Na2SiO3��ԭ�������������δ�ɶԵ��ӵ�Ԫ����Na�۵����Ų�3s1����1��δ�ɶԵ��ӣ�B�۵����Ų�2s22p1��δ�ɶԵ���Ϊ1����O�۵����Ų�2s22p4��δ�ɶԵ�����2����Si�۵����Ų�3s23p2��δ�ɶԵ�����2������δ�ɶԵ�����Ϊ2�������裻����������ԭ�ӹ��ɵ�ԭ�Ӿ��壬��SiO2�۵�ߣ�
NaBH4+Na2SiO3��ԭ�������������δ�ɶԵ��ӵ�Ԫ����Na�۵����Ų�3s1����1��δ�ɶԵ��ӣ�B�۵����Ų�2s22p1��δ�ɶԵ���Ϊ1����O�۵����Ų�2s22p4��δ�ɶԵ�����2����Si�۵����Ų�3s23p2��δ�ɶԵ�����2������δ�ɶԵ�����Ϊ2�������裻����������ԭ�ӹ��ɵ�ԭ�Ӿ��壬��SiO2�۵�ߣ�
(2)NaBO2+2SiO2+4Na+2H2![]() NaBH4+2Na2SiO3����ƽ��ѧ����ʽ�õ����ʵĶ�����ϵ����Ӧ��H2��Na�����ʵ���֮��Ϊ1��2��
NaBH4+2Na2SiO3����ƽ��ѧ����ʽ�õ����ʵĶ�����ϵ����Ӧ��H2��Na�����ʵ���֮��Ϊ1��2��
(3)������ˮ��Һ��������(H2SiO3)��Ӳ��ճ�ᣬ���м��ԣ��ǹ��������ˮ�����ɹ��ᣬSiO32��+2H2OH2SiO3+2OH�������칤���п����Ȼ����Ϊˮ������Ӳ��������Ϊ�������ƺ��Ȼ�臨���˫ˮ����ٽ����ɸ���������Ӳ����
(4)��BO2������H+��ϣ��������Һ����������ˮ�ķ�Ӧ����Au�Ļ��ϼ���+3����Ϊ0��BH4����HԪ�شө�1�����ߵ�+1�����ɵ����غ�ɵ�8Au3++3BH4����8Au��+3BO2����������Һ�����������Ӳμӷ�Ӧ�����ɵ���غ�������غ㶨�ɿɵã�8Au3++3BH4��+24OH���T8Au��+3BO2��+18H2O��
(5)�ڵ�ط�Ӧ�У�ÿ����1L 6mol/L H2O2��Һ������˫��ˮ�����ʵ���Ϊ6mol������֪H2O2+2e����2OH����������������·�еĵ�����![]() ��2NA/mol��12NA��
��2NA/mol��12NA��

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
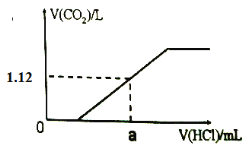
â���̸������Ծ�ϵ�д�����Ŀ����ͬ�¶��£��ֱ�����ʼ�����Ϊ1L�������ܱ������з�����Ӧ��X2(g)+3Y2(g)![]() 2XY3(g) ��H=-akJ/mol ʵ���÷�Ӧ���й��������±���
2XY3(g) ��H=-akJ/mol ʵ���÷�Ӧ���й��������±���
���� | ��Ӧ���� | ��ʼ���ʵ���/mol | �ﵽƽ������ʱ�� /min | �ﵽƽ������е������仯 | ||
X2 | Y2 | XY3 | ||||
�� | ���� | 1 | 3 | 0 | 10 | ����0.1akJ |
�� | ��ѹ | 1 | 3 | 0 | t | ����bkJ |
����������ȷ����
A. ����������Ӧ���������з�Ӧ��ƽ�ⳣ��K����ֵ��ͬ
B. ���У��ӿ�ʼ��10min�ڵ�ƽ����Ӧ������(X2)=0.1mol/(L��min)
C. ������X2��ƽ��ת����С��10%
D. b>0.1a