题目内容
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有 和 .
(2)锌与盐酸反应速率可以通过观察 进行判断,也可通过实验测定.通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是 或 .
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(氢气体积已换算为标准状况):
①哪一时间段反应速率最大 (填“0~1min”或“1~2min”或“2~3min”或“3~4min”或“4~5min”).
②2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为 .
③试分析1~3min时间段里,反应速率变大的主要原因 .
(2)锌与盐酸反应速率可以通过观察
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(氢气体积已换算为标准状况):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
②2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为
③试分析1~3min时间段里,反应速率变大的主要原因
考点:反应速率的定量表示方法,化学反应速率的影响因素
专题:化学反应速率专题
分析:(1)当加热或加入浓盐酸后,反应速率明显加快,说明是我的和浓度对反应速率的影响;
(2)锌和盐酸反应的速率可以利用分液过程中生成气体的快慢观察判断;实验测定反应速率,利用单位时间内物质质量的变化,气体体积变化等;
(3)①一段时间内收集的气体的体积越大,反应速率越大;
②根据v=
计算;
③开始反应时浓度逐渐变小,但温度逐渐升高.
(2)锌和盐酸反应的速率可以利用分液过程中生成气体的快慢观察判断;实验测定反应速率,利用单位时间内物质质量的变化,气体体积变化等;
(3)①一段时间内收集的气体的体积越大,反应速率越大;
②根据v=
| △c |
| △t |
③开始反应时浓度逐渐变小,但温度逐渐升高.
解答:
解:(1)当加热或加入浓盐酸后,反应速率明显加快,说明温度升高、浓度增大,可增大反应速率,则影响化学反应速率的因素有温度和浓度,
故答案为:温度;浓度;
(2)锌与盐酸反应速率可以通过观察反应过程中气体冒出的气泡速率分析,观察反应放出氢气的快慢观察反应速率;通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是单位时间内物质质量变化,或其他体积变化,测定锌的质量变化,氢气的生成体积,
故答案为:反应放出H2的快慢;锌的质量变化;生成氢气体积;
(3)①2~3min收集的气体的体积比其它时间段体积增大的大,则说明该时间段反应速率最大,故答案为:2~3min;
②2~3min时间段生成氢气体积为232ml-120mL=112mL,n(H2)=
=0.005mol,则消耗n(HCl)=0.01mol,v=
=
=0.1mol.L-1.min-1,
故答案为:0.1mol.L-1.min-1;
③开始反应时浓度逐渐变小,温度逐渐升高,但反应速率逐渐增大,说明反应放热成为影响速率的主要因素,故答案为:反应放热成为影响速率的主要因素.
故答案为:温度;浓度;
(2)锌与盐酸反应速率可以通过观察反应过程中气体冒出的气泡速率分析,观察反应放出氢气的快慢观察反应速率;通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是单位时间内物质质量变化,或其他体积变化,测定锌的质量变化,氢气的生成体积,
故答案为:反应放出H2的快慢;锌的质量变化;生成氢气体积;
(3)①2~3min收集的气体的体积比其它时间段体积增大的大,则说明该时间段反应速率最大,故答案为:2~3min;
②2~3min时间段生成氢气体积为232ml-120mL=112mL,n(H2)=
| 0.112L |
| 22.4L/mol |
| △c |
| △t |
| ||
| 1min |
故答案为:0.1mol.L-1.min-1;
③开始反应时浓度逐渐变小,温度逐渐升高,但反应速率逐渐增大,说明反应放热成为影响速率的主要因素,故答案为:反应放热成为影响速率的主要因素.
点评:本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握相关基础知识的积累,难度不大.

练习册系列答案
相关题目
下列图示的装置可以构成原电池的是( )
A、 硝酸银溶液 |
B、 稀H2SO4 |
C、 NaOH溶液 |
D、 乙醇 |
在碱性溶液中能大量共存且为无色透明的溶液的是( )
| A、K+、HCO3-、MnO4-、SO42- |
| B、Na+、SiO32-、NO3-、CO32- |
| C、Na+、Mg2+、NO3-、Cl- |
| D、Na+、SO42-、NH4+、Cl- |
用NA表示阿伏加德罗常数,下列说法正确的是( )
A、1个氢气分子的实际质量约为(
| ||
| B、含NA个氧原子的氧气在标准状况下的体积约为22.4L | ||
| C、过氧化钠与水反应,每产生标准状况下11.2L O2,转移NA个电子 | ||
| D、1mol Na 原子中含有NA个电子 |

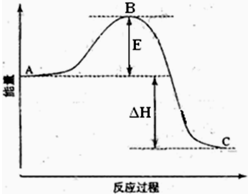 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题: