题目内容
(1)在Fe2O3+2Al
Al2O3+2Fe的反应中,氧化剂是 ;还原产物是 .
(2)标出上述方程式电子转移的方向与数目(用双线桥法) .
| ||
(2)标出上述方程式电子转移的方向与数目(用双线桥法)
考点:氧化还原反应的电子转移数目计算,氧化还原反应
专题:
分析:(1)氧化还原反应中,化合价升高元素所在的反应物是还原剂,对应产物是氧化产物,化合价降低元素所在的反应物是氧化剂,对应的产物是还原产物;
(2)氧化还原反应中,化合价升高元素失电子数=化合价降低元素得电子数=转移电子数,据此回答.
(2)氧化还原反应中,化合价升高元素失电子数=化合价降低元素得电子数=转移电子数,据此回答.
解答:
解:(1)Fe2O3+3Al
Al2O3+3Fe中,Fe元素化合价降低,被还原,Fe2O3为氧化剂,Fe是还原产物,Al元素化合价升高,被氧化,为还原剂,
故答案为:Fe2O3; Fe;
(2)氧化还原反应中,化合价升高元素失电子数=化合价降低元素得电子数=转移电子数,Fe得到2×3e-,Al失去2×3e-,电子转移数目和方向可表示为 ,
,
故答案为: .
.
| ||
故答案为:Fe2O3; Fe;
(2)氧化还原反应中,化合价升高元素失电子数=化合价降低元素得电子数=转移电子数,Fe得到2×3e-,Al失去2×3e-,电子转移数目和方向可表示为
 ,
,故答案为:
 .
.
点评:本题考查氧化还原反应,侧重于学生的分析能力的考查,为高频考点,注意把握元素化合价的变化,能会用双线桥法表示电子转移的方向和数目,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2012年全国“两会”的重要议题之一是节约资源和保护环境.下列说法错误的是( )
| A、废弃的金属、纸制品、塑料是可回收资源,玻璃不是可回收资源 |
| B、大力推广农作物的生物防治技术,以减少农药的使用 |
| C、“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D、“低碳生活”倡导生活中耗用能量尽量减少从而减少CO2排放 |
下列关于化学反应类型的叙述中,正确的是( )
| A、凡是生成盐和水的反应都是中和反应 |
| B、复分解反应可能是氧化还原反应 |
| C、生成一种单质和一种化合物的反应一定是置换反应 |
| D、有单质生成的分解反应一定是氧化还原反应 |
实现下列变化需加入还原剂的是( )
| A、Fe2O3→Fe |
| B、Cu→Cu(NO3)2 |
| C、SO3→H2SO4 |
| D、HCl→Cl2 |
标准状况下,下列物质占体积最大的是( )
| A、180gH2O |
| B、6.02×1023个CO2 |
| C、44.8LHCl |
| D、6gH2 |
下列抗酸药中和胃里过多的盐酸的离子方程式中书写正确的是( )
| A、NaHCO3溶于盐酸中:HCO3-+H+═H2O+CO2↑ |
| B、Na2O溶于盐酸中:O2-+2H+═H2O |
| C、Mg(OH)2溶于盐酸中:OH-+H+═H2O |
| D、CaCO3溶于盐酸中:CO32-+H+═H2O+CO2↑ |
将下列各组物质按酸、碱、盐分类,依次排列正确的( )
| A、硫酸、纯碱、小苏打 |
| B、硝酸、烧碱、明矾 |
| C、醋酸、乙醇、碳酸钙 |
| D、盐酸、熟石灰、生石灰 |
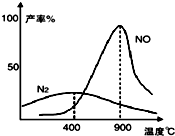 氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):