题目内容
8.实验室制取Cl2及性质的验证实验组合装置如下: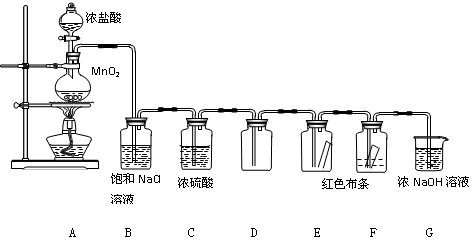
回答下列问题:
(1)A中的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)B的作用是除去HCl气体,C的作用是除去氯气中的水蒸气,得到干燥的氯气,防止对E中实验的干扰.
(3)E、F中观察到的现象分别是E中布条不褪色,F中布条褪色,你得到的结论是干燥的Cl2没有漂白性,Cl2与水反应的某种产物具有漂白性.
(4)G的作用是吸收氯气,防止环境污染,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
分析 根据实验装置图可知,A装置中用浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,B装置中用饱和食盐水除去氯化氢,再用C装置中浓硫酸干燥,D装置用向上排空法收集氯气,后将干燥的氯气通入E装置中干燥的有色布条,再通入F装置中湿润的有色布条,再用G装置中的氢氧化钠溶液吸收氯气尾气,据此答题.
解答 解:(1)根据装置图可知,A烧瓶中发生的反应为浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的化学方程式为 MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(2)根据上面的分析可知,C中盛装的试剂是浓硫酸,作用是除去氯气中的水蒸气,得到干燥的氯气,防止对E中实验的干扰,故答案为:除去氯气中的水蒸气,得到干燥的氯气,防止对E中实验的干扰;
(3)通入Cl2后,E中布条不褪色,F中布条褪色,根据现象可得出的结论是干燥的Cl2没有漂白性,Cl2与水反应的某种产物具有漂白性;
故答案为:E中布条不褪色,F中布条褪色;干燥的Cl2没有漂白性,Cl2与水反应的某种产物具有漂白性;
(4)G中盛有NaOH溶液,其作用是吸收氯气,防止环境污染,反应离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:吸收氯气,防止环境污染;Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查学生对性质实验方案设计题的掌握,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,侧重实验基本能力和基础知识的考查.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列说法不正确的是( )
| A. | 钠与硫化合时可以发生爆炸 | |
| B. | 等质量的两块钠与足厨氧气分别在加热条件下和常温条件下充分反应失去电子的数目一样多 | |
| C. | 钠着火燃烧时可用泡沫灭火器扑灭 | |
| D. | 工业上可用钠冶炼金属钛 |
16.有一澄清透明的酸性溶液,只可能含有大量Fe3+、Fe2+、Al3+、AIO2-,CO32-、NO3-6种离子中的几种,向溶液中逐滴加入一定量2mol•L-1的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NAOH溶液沉淀部分消失.下列判断正确的是( )
| A. | 一定不含Fe3+和Fe2+ | |
| B. | 一定含有Fe3+,但一定不含Fe2+ | |
| C. | 一定含有Al3+,Fe2+、Fe2+含有一种或两种 | |
| D. | 溶液可能含有NO3- |
13.(1)已知
25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1 648kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1 480kJ•mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇.发生的主要反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
由此计算△H1=-99kJ•mol-1;已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1 648kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1 480kJ•mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇.发生的主要反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
17.检验某溶液X中是否含有 Na+、K+、Fe3+、Mg2+、Iˉ、Cl-、CO32ˉ、SO42ˉ,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液.设计如下实验步骤,并记录相关现象.下列叙述不正确的是( )


| A. | 溶液X中一定含有Iˉ、CO32ˉ、SO42ˉ | |
| B. | 通过在黄色溶液中加入硝酸银溶液可以检验溶液X中是否存在Cl- | |
| C. | 试剂①为硝酸钡溶液 | |
| D. | 通过焰色反应,可确认溶液X中阳离子的种类 |
18.两个或多个同种含氧酸分子之间可以脱水形成相对分子质量更大的酸,如磷酸H3PO4可形成H4P2O7或H5P3O10等.下列物质不属于硫酸(H2SO4)脱水后形成的是( )
| A. | H2S2O7 | B. | H2S2O8 | C. | H2S3O10 | D. | H2S4O13 |
 消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.
消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题. 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: