题目内容
10.只用一种试剂就可以鉴别苯、碘化钾溶液、硝酸银溶液、己烯、四氯化碳,这种试剂是( )| A. | NaOH溶液 | B. | Na2SO4溶液 | C. | 溴水 | D. | Na2CO3 |
分析 苯、碘化钾溶液、硝酸银溶液、己烯、四氯化碳中,苯和四氯化碳都不溶于水,但二者密度不同,碘化钾具有还原性,硝酸银可与卤素离子生成沉淀,己烯含有C=C,能发生加成反应,以此来解答.
解答 解:A.苯、己烯都不溶于NaOH溶液,且密度都比水小,无法鉴别二者,故A错误;
B.苯、己烯都不溶于Na2SO4溶液,且密度都比水小,无法鉴别,故B错误;
C.苯和四氯化碳都不溶于水,加入溴水,振荡静置后,上层液体为橙色为苯;振荡静置后,下层液体为橙色的为四氯化碳;振荡静置后,液体分两层,均无色,因二溴己烷烷为无色,且不溶于水的为己烯;硝酸银加入溴水生成浅黄色沉淀;碘化钾溶液,为棕黄色溶液,比原橙色颜色加深,因为置换出单质碘,碘水颜色为棕黄色,故C正确;
D.苯、己烯都不溶于Na2CO3溶液,且密度都比水小,无法鉴别二者,故D错误.
故选C.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与实验能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
1.下列说法不正确的是( )
| A. | 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高 | |
| B. | 向盛有5mL 4%和5mL 12%的过氧化氢溶液中分别加入几滴等浓度的氯化铁溶液,后者产生气泡速率快 | |
| C. | KI溶液中加少量新制的氯水,再加少量苯充分振荡后静置,上层为紫红色 | |
| D. | 用pH试纸测溶液的pH和用红色石蕊试纸检测气体时均不需要润湿 |
5.氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.下列说法错误的是(注意:HCl与NH3极易反应而生成白烟)( )
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1molN2有6mol电子转移 | D. | 该反应属于复分解反应 |
15.用NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 1L1mol•L-1KClO3溶液中含有的氯离子数目为NA | |
| B. | 22.4LH2含有的分子数目为NA | |
| C. | 等质量的C2H2与C6H6含有的原子总数相等 | |
| D. | 1molZn变为Zn2+时失去的电子数目为NA |
2.下列物质的水溶液因水解而呈酸性的是( )
| A. | NaCl | B. | MgCl2 | C. | NaHCO3 | D. | H2CO3 |
7.茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案测定某品牌茶叶中钙元素的质量分数,并检验铁元素的存在(已知CaC2O4为白色沉淀物质).首先取200g茶叶样品焙烧得灰粉后进行如图操作:
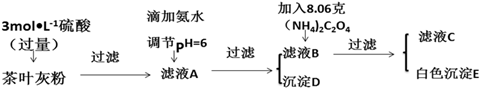
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
实验前要先将茶叶样品高温灼烧成灰粉,其主要目的使样品中的有机物完全分解,将钙、铁等微量元素转化为可溶性物质.
(2)写出从滤液A→沉淀D的离子反应方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,判断D已经沉淀完全方法是静置,向上层清液中继续滴加氨水若无红褐色沉淀生成则说明D已沉淀完全,否则未沉淀完全.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.

①此步操作过程中KMnO4标准溶液应装在图2中哪个仪器中(填写字母)B.
②滴定到终点,现象无色变为浅红色,静置后,如图3方法读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高(填“偏高”“偏低”或“无影响”).
(5)原茶叶中钙元素的质量分数为0.3%.

请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
(2)写出从滤液A→沉淀D的离子反应方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,判断D已经沉淀完全方法是静置,向上层清液中继续滴加氨水若无红褐色沉淀生成则说明D已沉淀完全,否则未沉淀完全.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.

①此步操作过程中KMnO4标准溶液应装在图2中哪个仪器中(填写字母)B.
②滴定到终点,现象无色变为浅红色,静置后,如图3方法读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高(填“偏高”“偏低”或“无影响”).
(5)原茶叶中钙元素的质量分数为0.3%.
8.常温下,在pH=1的某溶液中可能有Na+、Fe2+、Fe3+、I-、Cl-、CO32-中的几种,现取100mL,该溶液进行如下实验,根据实验结果,下列判断正确的是( )


| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | CO32-一定不存在,不能确定Na+和Cl-是否存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)至少为0.2mol•L-1 |
 尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
尿素[CO(NH2)2]是首个由无机物人工合成的有机物.