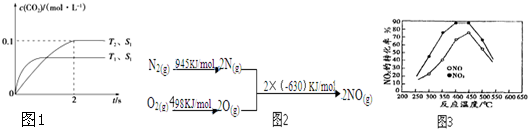
题目内容
一定质量的液态化合物XY2,在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)═XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
(1)反应前O2的体积是 .
(2)化合物XY2的摩尔质量是 .
(3)若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为 和 (写元素符号).请写出 Y的离子结构示意图为 .
(4)已知X元素有aX、bX、cX三种原子,Y元素有eY、f Y 两种原子,则它们能够形成 种XY2分子.
(1)反应前O2的体积是
(2)化合物XY2的摩尔质量是
(3)若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为
(4)已知X元素有aX、bX、cX三种原子,Y元素有eY、f Y 两种原子,则它们能够形成
考点:化学方程式的有关计算
专题:计算题
分析:(1)由方程式可知,反应前后气体的体积不发生变化;
(2)根据n=
计算氧气的物质的量,结合方程式计算XY2的物质的量,根据m=nM计算氧气质量,根据m=ρV生成物的质量,利用质量守恒定律计算XY2的质量,再根据M=
计算其摩尔质量;
(3)结合XY2的摩尔质量计算X、Y相对原子质量,进而确定X、Y为何元素,据此解答;
(4)利用原子之间相互组合确定.
(2)根据n=
| V |
| Vm |
| m |
| n |
(3)结合XY2的摩尔质量计算X、Y相对原子质量,进而确定X、Y为何元素,据此解答;
(4)利用原子之间相互组合确定.
解答:
解:(1)由方程式可知,反应前后气体的体积不发生变化,故氧气的体积等于反应后混合气体的体积,即氧气的体积为672mL,故答案为:672mL;
(2)氧气的物质的量=
=0.03mol,氧气的质量=0.03mol×32g/mol=0.96g,由方程式可知XY2的物质的量=0.03mol×
=0.01mol,生成物的质量=0.672L×2.56g/L=1.72g,根据质量守恒定律,XY2的质量=1.72g-0.96g=0.76g,故XY2的摩尔质量=
=76g/mol,
故答案为:76g/mol;
(3)XY2的摩尔质量为76g/mol,XY2分子中X、Y两元素的质量比是3:16,则X相对原子质量=76×
=12,Y的相对原子质量=
=32,故X为C元素、Y为S元素,S2-离子结构示意图为: ,
,
故答案为:C;S; ;
;
(4)X元素有aX、bX、cX三种原子,Y元素有eY、f Y 两种原子,原子之间相互组合,X有3种,Y2组合有3种,它们能够形成XY2分子为3×3种,
故答案为:9.
(2)氧气的物质的量=
| 0.672L |
| 22.4L/mol |
| 1 |
| 3 |
| 0.76g |
| 0.01mol |
故答案为:76g/mol;
(3)XY2的摩尔质量为76g/mol,XY2分子中X、Y两元素的质量比是3:16,则X相对原子质量=76×
| 3 |
| 19 |
| 76-12 |
| 2 |
 ,
,故答案为:C;S;
 ;
;(4)X元素有aX、bX、cX三种原子,Y元素有eY、f Y 两种原子,原子之间相互组合,X有3种,Y2组合有3种,它们能够形成XY2分子为3×3种,
故答案为:9.
点评:本题考查化学方程式计算、元素化合物推断等,难度不大,侧重考查学生分析思维能力,注意对基础知识理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对酸雨的pH描述中最准确的是( )
| A、小于7 |
| B、小于5.6 |
| C、在5.6~7之间 |
| D、等于5.6 |
有两个反应:①H2(g)+Cl2(g)
2HCl(g)、②H2(g)+Cl2(g)
2HCl(g),关于这两个反应的叙述不正确的是( )
| ||
| ||
| A、①、②两反应都是放热反应 |
| B、相同物质的量的H2、Cl2反应,①、②反应放出的热量一样多 |
| C、相同物质的量的H2、Cl2反应,①、②反应放出的热量不一样多 |
| D、①、②的能量转化方式主要是化学能转化为热能 |
下列有关说法正确的是( )
| A、合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
| B、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| C、100 mL pH=3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA酸性比HB弱 |
| D、Fe2+与[Fe(CN)6]3-反应生成红色的铁氰化亚铁沉淀 |