题目内容
17.将一定质量未去除氧化膜的镁条投入100mL某浓度的盐酸中,镁条恰好完全溶解,生成气体100.8mL(标准状况),向反应后的溶液中逐滴加入0.2mol•L-1的NaOH溶液,当Mg2+恰好完全沉淀,消耗NaOH溶液体积为50mL.(1)盐酸的物质的量浓度为0.1mol•L-1;
(2)该镁条中未被氧化的镁和被氧化的镁的物质的量之比9:1.
分析 当向反应后的溶液中逐滴加入0.2mol•L-1的NaOH溶液,当Mg2+恰好完全沉淀,消耗NaOH溶液体积为50mL,此时溶质为氯化钠,根据组成守恒n(HCl)=n(NaOH)=0.2mol•L-1×0.05L=0.01mol,由此分析解答.
解答 解:向反应后的溶液中逐滴加入0.2mol•L-1的NaOH溶液,当Mg2+恰好完全沉淀,消耗NaOH溶液体积为50mL,此时溶质为氯化钠,根据组成守恒n(HCl)=n(NaOH)=0.2mol•L-1×0.05L=0.01mol,
(1)盐酸的物质的量浓度为$\frac{0.01mol}{0.1L}$=0.1mol•L-1,故答案为:0.1;
(2)根据得失电子守恒:n(Mg)=n(H2)=$\frac{100.8mL×1{0}^{-3}L/mL}{22.4L/mol}$=0.0045mol,而投入100mL某浓度的盐酸中,镁条恰好完全溶解,此时得到单一溶质氯化镁,所以氯化镁的物质的量为:$\frac{0.01mol}{2}$=0.005mol,所以氧化镁的物质的量为:0.005mol-0.0045mol=0.0005mol,所以该镁条中未被氧化的镁和被氧化的镁的物质的量之比为:0.0045mol:0.0005mol=9:1,故答案为:9:1.
点评 本题考查混合物计算,难度中等,注意利用守恒法解答,侧重对学生的分析能力与解题方法技巧的考查.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
11.“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
①6CO2+6H2O$\stackrel{光合作用}{→}$C6H12O6+6O2
②CO2+3H2$→_{△}^{催化剂}$CH3OH+H2O
③CO2+CH4$→_{△}^{催化剂}$CH3COOH
④2CO2+6H2$→_{△}^{催化剂}$CH2═CH2+4H2O
关于以上反应的说法,不正确的是( )
①6CO2+6H2O$\stackrel{光合作用}{→}$C6H12O6+6O2
②CO2+3H2$→_{△}^{催化剂}$CH3OH+H2O
③CO2+CH4$→_{△}^{催化剂}$CH3COOH
④2CO2+6H2$→_{△}^{催化剂}$CH2═CH2+4H2O
关于以上反应的说法,不正确的是( )
| A. | 反应①是最节能的,同时原子利用率最高 | |
| B. | 反应①是最节能的,反应③的原子利用率最高 | |
| C. | 在反应②中,CO2作为氧化剂 | |
| D. | 反应④得到的产物可以作为生产塑料的原料 |
8.有机物的命名是有规则的,下列有机物命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. | 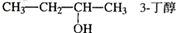 | ||
| C. | 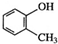 甲基苯酚 甲基苯酚 | D. | 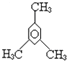 1,3,5-三甲基苯 1,3,5-三甲基苯 |
5.在无色溶液里能大量共存,但加入盐酸后不能大量共存的离子组是( )
| A. | Fe3+、K+、Ag+、NO3-、 | B. | Na+、K+、CO32-、C1- | ||
| C. | NH4+、Al3+、Cl-、NO3- | D. | Mg2+、Na+、CO32-、SO42- |
12.短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体.判断下列说法不正确的是( )
| A. | M元素位于周期表中的第三周期第VIA族 | |
| B. | Z元素是硅,其在自然界中存在游离态 | |
| C. | X与M的单质在高温下反应得到的二元化合物分子中,存在极性共价键 | |
| D. | 四种元素中的Y单质可用于航空航天合金材料的制备 |
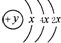 ,B、C可形成离子化合物B3C2,B离子与C离子具有相同的电子层结构,D的气态氢化物H2D的还原性较强.
,B、C可形成离子化合物B3C2,B离子与C离子具有相同的电子层结构,D的气态氢化物H2D的还原性较强.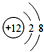 .
.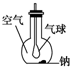 如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到钠表面变暗,气球膨胀,发生反应的化学方程式为4Na+O2═2Na2O.
如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到钠表面变暗,气球膨胀,发生反应的化学方程式为4Na+O2═2Na2O.