题目内容
【题目】铅的冶炼有很多种方法。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
① 2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反应PbS(s)+2O2(g)=PbSO4(s) ΔH=______________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为______________ (保留两位有效数字);若向容器中充入一定量的CO气体后,平衡向_________ (填“正向”、“逆向”或“不”)移动,再次达到平衡时,CO的转化率_________(填“增大”、“减小”或“不变”)。
【答案】(2/3a+2/3b-c)<9.1%正向不变
【解析】
(1)根据盖斯定律书写目标热化学方程式;
(2)①利用lgK与K是增比例函数,温度越高K值越小,说明正反应是放热反应;
②当lgK=1,则K=10,根据平衡常数表达式求出混合气体中CO的体积分数。
(1)根据盖斯定律ΔH=(ΔH1+2ΔH2)![]() -ΔH3=2/3a+2/3b-c)kJ·mol-1;
-ΔH3=2/3a+2/3b-c)kJ·mol-1;
因此,本题正确答案是:(2/3a+2/3b-c);
(2)①利用lgK与K是增比例函数,温度越高K值越小,说明正反应是放热反应。
因此,本题正确答案是:<;
②lgK=1,则K=10,在PbO(s)+CO(g)![]() Pb(s)+CO2(g)中,设起始通入CO的amol/L,达平衡时转化的量为xmol/L,平衡时CO的(a-x)mol/L,CO2的浓度为xmol/L,则K=
Pb(s)+CO2(g)中,设起始通入CO的amol/L,达平衡时转化的量为xmol/L,平衡时CO的(a-x)mol/L,CO2的浓度为xmol/L,则K=![]() =10,得
=10,得![]() =9.1%。若向容器中充入一定量的CO气体后,平衡向正向移动;由于相当于加压,气体分子数不变,所以再次达到平衡时CO的转化率不变。
=9.1%。若向容器中充入一定量的CO气体后,平衡向正向移动;由于相当于加压,气体分子数不变,所以再次达到平衡时CO的转化率不变。
因此,本题正确答案是:9.1%;正向;不变。

【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法错误的是
A. 4~5min内,该反应的正、逆反应速率相等
B. 若要提高SO3的产率,则可用过量的空气代替O2
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.015mol/ (L·min)
D. 容器内反应达到平衡状态时的压强与起始时的压强之比为5∶4
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。
Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4=Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:

实验(二)Li2FeSiO4含量测定:

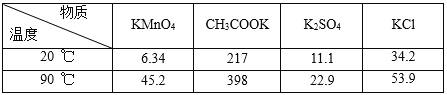
从仪器B中取20.00mL溶液至锥形瓶中,另取0.20molL-1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 22.40mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B____,仪器C____。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是____。
(3)在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需____;
(4)操作Ⅱ的步骤是:__、__、过滤、洗涤。
(5)还原剂A可用SO2,写出该反应的离子方程式____,此时后续处理的主要目的是____。
(6)滴定终点时现象为____;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为____;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量____(填“偏高”、“偏低”或“不变”)。
【题目】在一定条件下有反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述不正确的是:
A. Q1<197
B. 在上述条件下,反应生成1molS03气体放热98.5kJ
C. Q2=Q3
D. Q3<Q1<2Q2