题目内容
【题目】高锰酸钾是一种常用的氧化剂。如图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去):

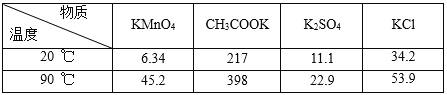
相关物质不同温度下的溶解度(单位:g)数据如表:
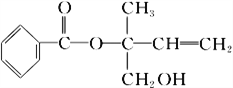
(1)“熔融”步骤反应的化学方程式为_____。
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:_____。
(3)操作2是_____、_____、_____。
(4)图中可以直接进行循环利用的物质是_____(填化学式)。
(5)KMnO4粗晶体中的主要杂质(填化学式)有_____和_____,若用硫酸代替图中的冰醋酸,则导致的问题及原因是_____。
【答案】3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O 3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO- 蒸发浓缩(或加热浓缩) 冷却结晶(或降温结晶) 过滤 MnO2 KCl CH3COOK 反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低或硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低
3K2MnO4+KCl+3H2O 3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO- 蒸发浓缩(或加热浓缩) 冷却结晶(或降温结晶) 过滤 MnO2 KCl CH3COOK 反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低或硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低
【解析】
(1)根据流程,“熔融”步骤中加入原料是KClO3、KOH、MnO2,得到K2MnO4,Mn的化合价由+4价升高到+6价,化合价升高,MnO2为还原剂,KClO3为氧化剂,被还原成KCl,根据化合价升降法进行配平,即化学方程式为:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O;
3K2MnO4+KCl+3H2O;
(2)根据流程,加入冰醋酸,得到KMnO4、CH3COOK、MnO2,只有Mn的化合价发生改变,即K2MnO4既是氧化剂又是还原剂,根据化合价升降法进行配平,得出离子方程式为3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-;
(3)滤液1中主要成分是KMnO4、CH3COOK、KCl,操作2是从溶液中得到溶质固体,结合KMnO4的溶解度随温度的降低而减小,则操作2应为蒸发浓缩、冷却结晶、过滤;
(4)经过操作1后所得滤渣的主要成分是MnO2,,与软锰矿的主要成分相同,也是唯一可以循环利用的物质;
(5)KMnO4粗晶体中主要含有的杂质为KCl、CH3COOK,若用硫酸代替图中的冰醋酸,生成K2SO4在常温下溶解度较小,析出从而导致产品的纯度降低,同时硫酸的酸性太强,导致MnO4-将Cl-氧化产生有毒的Cl2,KMnO4损失且纯度降低。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】在下列影响化学反应速率的因素中,能使化学反应速率加快的方法是( )
①升高温度 ②加入催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末
A. ①②③ B. ①②④ C. ①③④ D. ①②③④
【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
【题目】铅的冶炼有很多种方法。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
① 2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反应PbS(s)+2O2(g)=PbSO4(s) ΔH=______________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为______________ (保留两位有效数字);若向容器中充入一定量的CO气体后,平衡向_________ (填“正向”、“逆向”或“不”)移动,再次达到平衡时,CO的转化率_________(填“增大”、“减小”或“不变”)。