题目内容
12.铁是用途最广的金属材料之一,但生铁易生锈.请讨论电化学实验中有关铁的性质.(1)①某原电池装置如图1所示,右侧烧杯中的电极反应式为2H++2e-=H2↑,一段时间后,左侧烧杯中的[Cl-]将增大(填“增大”、“减小”或“不变”).
②已知图2甲、乙两池的总反应式均为Fe+H2SO4═FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2.则甲池中的左电极材料为Fe (填“Fe”或“C”),乙池中的右电极材料为C(填“Fe”或“C”).
(2)装置图2丙中,易生锈的是a点(填“a”或“b”).装置图2丁中可观察到的实验现象是生铁表面生成红棕色锈斑,试管内液面上升.

分析 (1)①图1为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生2H++2e-=H2;原电池中阴离子向负极移动;
②Fe和H2SO4之间的反应结合电解池和原电池的原理分析回答;
(2)装置丙中,根据易生锈的是构成原电池作负极的分析,根据吸氧腐蚀消耗了空气中的氧气,使试管内压强降低,则大气压使试管中液面会上升.
解答 解:(1)①图中为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生2H++2e-=H2↑;原电池中阴离子向负极移动,所以左侧烧杯中的c(Cl-)增大;
故答案为:2H++2e-=H2↑;增大;
②Fe和H2SO4之间的反应,如果设计电解池实现,金属铁作阳极,阳极:Fe-2e-=Fe2+,电解质为硫酸,阴极是氢离子放电,电极反应为2H++2e-=H2↑,即阳极为铁,阴极为C;如果设计原电池实现,金属铁作负极,负极:Fe-2e-=Fe2+,电解质为硫酸,正极是氢离子放电,电极反应为2H++2e-=H2↑,即负极为铁,正极为C;甲:左边为Fe,右边为C;乙:左边为Fe,右边为C;故答案为:Fe,C;
(2)装置丙中,a点与空气接触符合构成原电池的条件,易生锈;装置丁中发生吸氧腐蚀消耗了空气中的氧气,生铁表面生成红棕色锈斑,使试管内压强降低,则大气压使试管中液面会上升;故答案为:a;生铁表面生成红棕色锈斑,试管内液面上升.
点评 本题主要考查了原电池、电解池的原理及其应用,难度不大,重点要掌握基本原理.

练习册系列答案
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
19. NPG(新戊二醇)是一种可用作太阳能储存热量的物质.已知:NPG的结构式如图.有关NPG的说法不正确的是( )
NPG(新戊二醇)是一种可用作太阳能储存热量的物质.已知:NPG的结构式如图.有关NPG的说法不正确的是( )
 NPG(新戊二醇)是一种可用作太阳能储存热量的物质.已知:NPG的结构式如图.有关NPG的说法不正确的是( )
NPG(新戊二醇)是一种可用作太阳能储存热量的物质.已知:NPG的结构式如图.有关NPG的说法不正确的是( )| A. | NPG的分子式为C5H12O2 | B. | NPG沸点比乙二醇的高 | ||
| C. | NPG一定条件下能发生消去反应 | D. | NPG的氧化产物可发生银镜反应 |
3.某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和5.4gH2O.下列说法正确的是( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中一定含有氧元素 | ||
| C. | 该化合物中碳、氢原子个数比为1:2 | D. | 该有机物的分子式为C2H6 |
7.燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是( )
| A. | 负极反应式:O2+2H2O+4e-═4OH- | |
| B. | 负极反应式:CH4+8OH--8e-═CO2+6H2O | |
| C. | 随着放电的进行,溶液中的氢氧根离子浓度不变 | |
| D. | 放电时溶液中的阴离子向负极移动 |
2.某有机化合物8.80g,在充足的氧气中完全燃烧后得二氧化碳22.0g和10.8g水(没有其他产物).该化合物的实验式(最简式)是( )
| A. | C5H6O | B. | C5H12 | C. | C5H12O2 | D. | C5H12O |
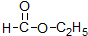 酯; ②
酯; ②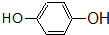 酚;
酚;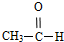 醛;④
醛;④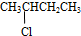 卤代烃;⑤
卤代烃;⑤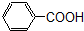 羧酸;
羧酸;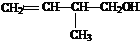
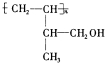 .
. 某同学用铁、铜作为电极,稀硫酸作为电解液组成原电池,如图所示,完成下列空格.(涉及到电极填写具体物质的元素符号)
某同学用铁、铜作为电极,稀硫酸作为电解液组成原电池,如图所示,完成下列空格.(涉及到电极填写具体物质的元素符号)