题目内容
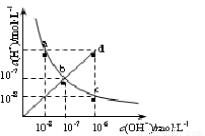
25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是
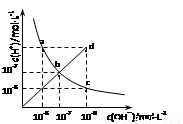
A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14
B.b d线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25℃,pH<7
D.CH3COONa溶液不可能位于c点
【答案】
D
【解析】
试题分析:A、ac曲线为25℃时的离子积常数曲线,在其任意一点上c(H+)·c(OH-)=10-14,故A正确;B、bd线段c(H+)=c(OH-),其任意一点对应的溶液都呈中性,故B正确;C、bd线对应溶液中c(H+)与c(OH-)相等,温度升高曲线向d点移动c(H+)与c(OH-)相等的值变小,故C正确;D、CH3COONa溶液中CH3COO-离子水解产生OH-离子,使溶液中c(OH-)> c(H+),故D错误。
考点:离子积常数

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线ac所示,下列判断错误的是( )
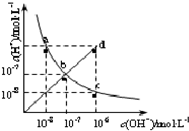

| A、a c曲线上的任意一点都有c(H+)?c(OH-)=10-14 | B、b d线段上任意一点对应的溶液都呈中性 | C、d点对应溶液的温度高于25℃,pH<7 | D、CH3COONa溶液不可能位于c点 |
常见的无机酸25℃时在水溶液中的电离平衡常数如下表
|
无机酸 |
氢氰酸(HCN) |
碳酸(H2CO3) |
氢氟酸(HF) |
|
电离平衡常数K值 |
6.2×10—10(K) |
4.2×10—7(K1) 5.6×10—11(K2) |
6.61×10—4(K) |
下列选项正确的是
A.氟化钠溶液中通入过量CO2:F—+H2O+CO2=HF+HCO3—
B.Na2CO3溶液中:2c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3)
C.中和等体积、等pH的氢氰酸(HCN)和氢氟酸(HF)消耗NaOH的量前者大于后者
D.等浓度的NaCN和NaF溶液中pH值前者小于后者
 (3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.
(3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.