题目内容
蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名。蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成。工业上由蛇纹石制取碱式碳酸镁产品的流程如下: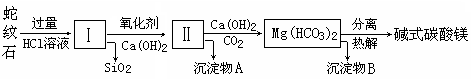
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是________。
(2)向Ⅰ中加入氧化剂的作用是 ,加入Ca(OH)2时,
需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表)。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
若pH>8可能会导致 溶解、________沉淀。
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入 ,然
后过滤、洗涤、_________(填写实验操作名称),即可获得红色颜料,实现废物的综合利用。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)若产品的化学式用aMgCO3·bMg(OH)2·cH2O表示,现称取18.2 g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0 g MgO,通过计算确定产品的化学式中:a=________,b=________,c=________。
(1)Fe3+、Fe2+ (各1分,共2分)
(2)将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3,(2分) Al(OH)3 Mg2+(各1分,共2分)
(3)NaOH溶液(其它可溶性强碱也可),(干燥)灼烧,(各1分。共2分)
(4)CO2(2分)
(5)3 1 3(3分,对一个数字给1分)
解析试题分析:(1)蛇纹石矿加盐酸溶解,发生反应的化学方程式为MgO+2HCl=MgCl2+H2O,FeO+2HCl=FeCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O。SiO2不与盐酸反应,以固体形式先除去,因此,溶液中除了Mg2+、Al3+外,还有的金属离子是Fe2+和Fe3+。
(2)这时溶液中的Fe3+、Al3+是杂质,但除去Fe3+、Al3+的过程中一定不能将Mg2+损失,为了达到这个目的,根据题中提示应用的原理是Fe3++3H2O Fe(OH)3+3H+和Al3++3H2O
Fe(OH)3+3H+和Al3++3H2O Al(OH)3+3H+,只要加入一种能消耗H+的物质即可使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,该方案使用加Ca(OH)2的方法,但此步加入Ca(OH)2不能太多,需将溶液的pH控制在7~8。若pH小于7,Al3+不能完全沉淀;若pH过高导致生成的Al(OH)3又发生反应Al(OH)3+OH-=AlO2-+2H2O而溶解,同时Mg2+也转化为沉淀而损失。
Al(OH)3+3H+,只要加入一种能消耗H+的物质即可使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,该方案使用加Ca(OH)2的方法,但此步加入Ca(OH)2不能太多,需将溶液的pH控制在7~8。若pH小于7,Al3+不能完全沉淀;若pH过高导致生成的Al(OH)3又发生反应Al(OH)3+OH-=AlO2-+2H2O而溶解,同时Mg2+也转化为沉淀而损失。
(3)制纯净Fe2O3,应先将其中含有的少量Al(OH)3除去,除去Al(OH)3的方法是利用它能溶于强碱的性质。
(4)此过程中CO2是可以重复使用的。
(5)实验目的是确定碱式碳酸镁组成的方案,其反应原理是aMgCO3?bMg(OH)2?cH2O (a+b)MgO+aCO2↑+(b+c)H2O↑,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量(或体积);④生成水的质量。
(a+b)MgO+aCO2↑+(b+c)H2O↑,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量(或体积);④生成水的质量。
(6)m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,根据质量守恒得
m(H2O)=18.2g-6.6g-8.0g=3.6g
则m(MgO)= =0.2mol
=0.2mol
n(CO2)= =0.15mol
=0.15mol
n(H2O)= =0.2mol
=0.2mol
即a∶b∶c=0.15∶0.05∶0.15=3∶1∶3
所以a=3、b=1、c=3
考点:考查物质的分离和提纯、化学工艺流程、实验方案设计和化学计算
点评:该题是高考中的常见题型,试题综合性强,难度较大,学生不易得分。这类试题涉及的情景新颖,还时常出现一些化工术语。这类题目是通过对某种重要化工产品的工业生产流程图的分析,以物质的制备、分离、提纯为试题环境,以元素化合物知识、实验基本操作、化学反应原理、化学化学平衡原理、水解原理、绿色化学观点、安全生产的知识为考查目标,以信息的获取、加工、整合和新情境下实际问题的分析、综合、解决及经济的视角分析实际生产中的各种问题为考查能力目标。

 名校课堂系列答案
名校课堂系列答案(1)高温电解技术能高效实现CO2(g) + H2O(g) ="CO(g)" + H2(g) +O2(g) ,工作原理示意图如下: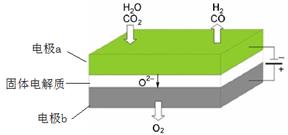
①电极b发生 (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是 。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: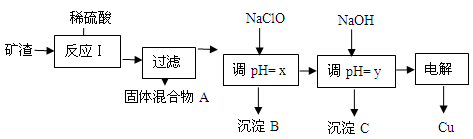
已知: Cu2O + 2H+ =" Cu" + Cu2+ + H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是 。
②反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是 。
④下列关于NaClO调pH的说法正确的是 (填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+
 HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O
 HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、
负极,并写出电极反应式。
正极反应: 。
负极反应: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀 完全时的pH |
| Fe3+ Fe2+ | 1.9 7.0 | 3.2 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式 ; ;劣质不锈钢腐蚀的实验现象 。
现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,
以下是以硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁αFe2O3)的生产流程示意图:
(1)步骤Ⅰ中过滤所得滤渣的主要成分是________。
(2)步骤Ⅱ中加入铁粉的目的是________。
(3)步骤Ⅲ中可选用________调节溶液的pH。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
(5)从滤液C中回收的主要物质的一种用途是_________________________________。
目前世界上60%的镁是从海水中提取的。已知海水提取镁的主要步骤如下: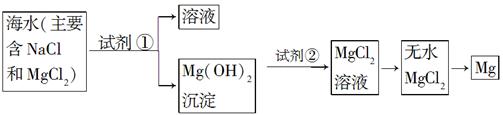
(1)关于加入试剂①作沉淀剂,有以下几种不同方法,请完成下列问题。
| 方法 | 是否正确 | 简述理由 |
| 方法1:直接往海水中加入沉淀剂 | 不正确 | (一) |
| 方法2:高温加热蒸发海水后,再加入沉淀剂 | (二) | (三) |
| 你认为最合理的其他方法是: (四) | ||
(一)_______________________________________________;
(二)_______________________________________________;
(三)______________________________________________;
(四)______________________________________________。
(2)框图中加入的试剂①应该是________(填化学式);加入的试剂②是________(填化学式);工业上由无水MgCl2制取镁的化学方程式为________________________________________。
从含有Ag+、Fe3+和Al3+的溶液中,按下图所示方法分离提取金属单质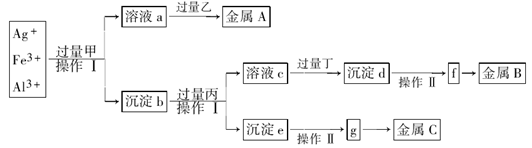
已知:实验时甲、乙、丙、丁四种物质只能从碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中选择,也可用这四种溶液来制取。对该实验过程的分析正确的是
| A.丙是NaOH,丁是稀H2SO4 |
| B.乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来 |
| C.操作I是过滤和洗涤沉淀。洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次 |
| D.g是氧化物,金属c采用电解法获得 |

 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2