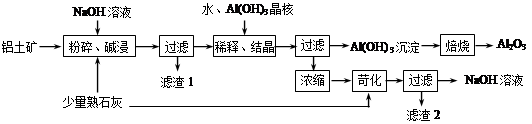题目内容
(1)高温电解技术能高效实现CO2(g) + H2O(g) ="CO(g)" + H2(g) +O2(g) ,工作原理示意图如下: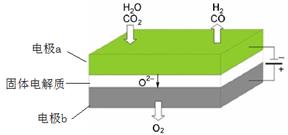
①电极b发生 (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是 。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: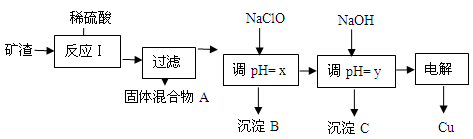
已知: Cu2O + 2H+ =" Cu" + Cu2+ + H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是 。
②反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是 。
④下列关于NaClO调pH的说法正确的是 (填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+
 HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O
 HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
(1)① 氧化(2分) ② CO2 + 2e- = CO+O2-(2分)
(2)①SiO2、Cu(各1分) ②Fe2+(2分) 2Fe3+ + Cu = Cu2+ + 2Fe2+(2分)
③5.2≤pH<5.4 (2分) ④ b (2分) ⑤ 5:11 (3分)
解析试题分析:(1)①根据工作原理示意图可知,电极b上O2?转化为O2,失去电子发生氧化反应。
②CO2在电极a上得电子,转化为CO和O2?,电极方程式为:CO2 + 2e- = CO+O2-
(2)①SiO2为不溶于硫酸的难溶物,根据信息:Cu2O + 2H+ =" Cu" + Cu2+ + H2O,所以加入稀硫酸后得到固体混合物含SiO2、Cu
②因为固体混合物中有单质Cu存在,所以Fe元素的存在形式为Fe2+;发生Cu还原Fe3+的反应:2Fe3+ + Cu = Cu2+ + 2Fe2+
③加入NaOH调pH=y的目的是让Al3+转化为Al(OH)3沉淀,所以y对应的数值范围是5.2≤pH<5.4
④a、加入NaClO使溶液的pH升高,错误;b、因为HClO为弱酸,所以加入NaClO后发生反应:ClO-+ H+ HClO,使溶液pH升高,正确;c、NaClO溶液只有少量ClO?发生水解反应,ClO?浓度大, NaClO能调节pH的主要原因是发生发生反应:ClO-+ H+
HClO,使溶液pH升高,正确;c、NaClO溶液只有少量ClO?发生水解反应,ClO?浓度大, NaClO能调节pH的主要原因是发生发生反应:ClO-+ H+ HClO,错误。
HClO,错误。
⑤设CuSO4?5H2O的质量为x,H2O的质量为y,则160/250x÷(x+y)×100%=20%,可得x:y=5:11。
考点:本题考查化学工艺流程的分析、电解原理及应用、质量分数的计算。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名。蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成。工业上由蛇纹石制取碱式碳酸镁产品的流程如下: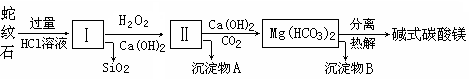
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是________。
(2)向Ⅰ中加入H2O2的作用是 ,有关离子方程式 ,加入Ca(OH)2时, 需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表)。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入 溶液,然后过滤、洗涤、 _________(填写实验操作名称),即可获得红色颜料,实现废物的综合利用。
(4)若产品的化学式用aMgCO3·bMg(OH)2·cH2O表示,现称取18.2 g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0 g MgO,通过计算确定产品的化学式中:a=________,b=________,c=________。
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下。
一些氢氧化物沉淀的pH如下表。
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题。
(1)实验室进行步骤④的操作名称为________。
(2)固体A的化学式为________,物质C的化学式为________。
(3)步骤④调节pH的范围为________。
(4)步骤⑥反应的化学方程式为________。
蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名。蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成。工业上由蛇纹石制取碱式碳酸镁产品的流程如下:
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是________。
(2)向Ⅰ中加入氧化剂的作用是 ,加入Ca(OH)2时,
需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表)。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
若pH>8可能会导致 溶解、________沉淀。
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入 ,然
后过滤、洗涤、_________(填写实验操作名称),即可获得红色颜料,实现废物的综合利用。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)若产品的化学式用aMgCO3·bMg(OH)2·cH2O表示,现称取18.2 g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0 g MgO,通过计算确定产品的化学式中:a=________,b=________,c=________。