题目内容
3. 前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态;Y基态原子的L层有2个未成对电子;Z基态原子的最外层电子排布为3s23p2;Q、R、W都属于金属元素,Q、W基态原子核外均没有未成对电子,R基态原子的d轨道上有3个空轨道.
前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态;Y基态原子的L层有2个未成对电子;Z基态原子的最外层电子排布为3s23p2;Q、R、W都属于金属元素,Q、W基态原子核外均没有未成对电子,R基态原子的d轨道上有3个空轨道.请回答下列问题:
(1)R基态原子的电子排布式为1s22s22p63s23p63d24s.上述六种元素中,属于ds区的元素符号是Zn;
(2)含有16个中子的Z的核素符号为3014Si.X、Y、Z元素原子中第一电离能由高到低的顺序是N>O>Si.
(3)XY3-的离子空间构型为平面三角形,与该离子互为等电子体的一种分子是SO3.
(4)X、Y分别与氢元素形成的最简单氢化物分子中,后者的键角小于前者的原因是NH3、H2O的中心原子杂化方式相同,由于氨分子存在一对孤电子对,水分子存在两对孤电子对,水分子中孤电子对对成键电子排斥力更强,所以水分子的键角比氨分子的键角小.
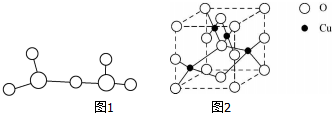
(5)Y、Q、R三种元素形成的某种化合物的如图所示,该化合物的化学式为CaTiO3.若Y与最近的R的距离为a cm,阿伏加德常数的值为NA,则计算此晶体的密度表达式为$\frac{136}{(\sqrt{2}a)^{3}×{N}_{A}}$g/cm3(不必化简).
分析 前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态,原子核外电子排布式为1s22s22p3,故X为N元素;Y基态原子的L层有2个未成对电子,原子序数大于N,则Y原子核外电子排布式为1s22s22p4,故Y为O元素;Z基态原子的最外层电子排布为3s23p2,则Z为Si;Q、R、W都属于金属元素,只能处于第四周期,其中R基态原子的d轨道上有3个空轨道,其原子外围电子排布式为3d24s2,则R为Ti,Q、W基态原子核外均没有未成对电子,Q原子序数小于Ti,则Q为Ca,W外围电子排布式为3d104s2,则W为Zn,据此解答.
解答 解:前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态,原子核外电子排布式为1s22s22p3,故X为N元素;Y基态原子的L层有2个未成对电子,原子序数大于N,则Y原子核外电子排布式为1s22s22p4,故Y为O元素;Z基态原子的最外层电子排布为3s23p2,则Z为Si;Q、R、W都属于金属元素,只能处于第四周期,其中R基态原子的d轨道上有3个空轨道,其原子外围电子排布式为3d24s2,则R为Ti,Q、W基态原子核外均没有未成对电子,Q原子序数小于Ti,则Q为Ca,W外围电子排布式为3d104s2,则W为Zn.
(1)R基态原子的d轨道上有3个空轨道,基态原子的电子排布式为1s22s22p63s23p63d24s,上述六种元素中,属于ds区的元素符号是Zn,
故答案为:1s22s22p63s23p63d24s;Zn;
(2)含有16个中子的Si的核素符号为3014Si,同周期随原子序数增大第一电离能呈增大趋势,同主族自上而下第一电离能减小,氮元素原子2p能级为半满稳定状态,第一电离能高于氧元素的,故第一电离能:N>O>Si,
故答案为:3014Si;N>O>Si;
(3)NO3-中N原子孤电子对数=$\frac{5+1-2×3}{2}$=0、价层电子对数=3+0=3,故离子空间构型为平面三角形,与该离子互为等电子体的一种分子是SO3等,
故答案为:平面三角形;SO3等;
(4)X、Y分别与氢元素形成的最简单氢化物分别为NH3、H2O,NH3、H2O的中心原子杂化方式相同,由于氨分子存在一对孤电子对,水分子存在两对孤电子对,水分子中孤电子对对成键电子排斥力更强,所以水分子的键角比氨分子的键角小,
故答案为:NH3、H2O的中心原子杂化方式相同,由于氨分子存在一对孤电子对,水分子存在两对孤电子对,水分子中孤电子对对成键电子排斥力更强,所以水分子的键角比氨分子的键角小;
(5)晶胞中Ti原子位于顶点,Ti数目为8×$\frac{1}{8}$=1,O原子为位于面心,O原子数目为6×$\frac{1}{2}$=3,Ca原子为体心,Ca数目为1,故该化合物的化学式为CaTiO3,晶胞质量为$\frac{136}{{N}_{A}}$g,Y与最近的R的距离为a cm,则晶胞边长为2a cm×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$a cm,晶体的密度为$\frac{136}{{N}_{A}}$g÷($\sqrt{2}$a cm)3=$\frac{136}{(\sqrt{2}a)^{3}×{N}_{A}}$g/cm3,
故答案为:CaTiO3;$\frac{136}{(\sqrt{2}a)^{3}×{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、元素周期表、电离能、空间构型、等电子体、价层电子对互斥理论、晶胞计算等,推断元素是解题关键,注意利用均摊法进行晶胞有关计算,难度中等.

(1)NaHCO3俗称小苏打,其水溶液显碱性的原因是(用离子方程式表示)HCO3-+H2O?H2CO3+OH-.
(2)工业上制备NaHCO3的方法是:先向饱和食盐水通入足量的NH3,再通入过量的CO2得到NaHCO3沉淀,写出该反应的化学方程式NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl.
(3)泡沫灭火器内含一定浓度的NaHCO3(置于铁桶内)和Al2(SO4)3溶液(置于玻璃瓶内)以及起泡剂,使用时把灭火器倒置即有泡沫状物质喷出.
①倒置灭火器时发生反应的离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑;
②有人认为Na2CO3价格便宜,建议用等物质的量浓度、等体积的Na2CO3溶液代替NaHCO3溶液.你认为此建议不合理(填“合理”或“不合理”),理由是等浓度、等体积的NaHCO3与Na2CO3相比,和Al2(SO4)3溶液反应时,NaHCO3生成的CO2既快又多.
(4)由NaHCO3和KHCO3组成的混合物,与50mL等浓度的盐酸分别反应,测得如下数据:
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
②所用盐酸的物质的量浓度是3mol•L-1.
| A. | 化学反应速率是化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| C. | 在同一个反应中,可以用反应物或生成物来表示反应速率 | |
| D. | 化学反应速率的常用单位有mol/(L•s)和mol/(L•min) |
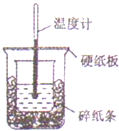 50ml0.5mol•L-1盐酸与50ml•L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
50ml0.5mol•L-1盐酸与50ml•L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )| A. | 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题 | |
| B. | 大烧杯上如不盖硬纸板,测得的中和热数值会偏大 | |
| C. | 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大 | |
| D. | 实验中改用60ml0.5mol•L-1盐酸跟50ml0.55mol•L-1NaOH溶液进行反应,与上实验相比,所放出的热量不相等,但是所求中和热相等 |
| A. | 铁制品锈蚀时主要发生析氢腐蚀 | |
| B. | 施用适量石膏可以降低盐碱地(含较多NaCl、Na2CO3)的碱性 | |
| C. | 电镀厂未经处理的废水可以直接用来灌溉农田 | |
| D. | 将水坝的钢铁闸门与直流电的正极相连可以防闸门腐蚀 |
| A. | 硫酸、纯碱、氯化钙 | B. | 盐酸、烧碱、小苏打 | ||
| C. | 碳酸、乙醇、醋酸钠 | D. | 磷酸、熟石灰、过氧化钠 |
| A. | 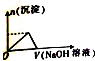 | B. | 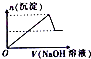 | C. |  | D. |  |
| A. | 一定有SO2、NH3和NO | B. | 一定有NO和HCl | ||
| C. | 可能有Cl2和O2 | D. | 一定没有Cl2、NO2、NH3和O2 |