题目内容
有以下物质:①CH4,②C2H4,③H2O,④NH3,⑤CH2O,⑥CO2;
非极性分子的是 ;既有σ键又有π键的是 ;中心原子没有孤电子对的是 ;中心原子杂化类型为
sp3的是 ;分子构型都是直线形的是 .(写序号)
非极性分子的是
sp3的是
考点:极性分子和非极性分子,共价键的形成及共价键的主要类型,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键;
单键中只有σ键,双键中有一个σ键和一个π 键,三键中有一个σ键和两个π 键;
分子中孤电子对个数=
(中心原子价电子数-配原子个数×配原子形成稳定结构需要的电子数);
根据分子的组成判断形成的δ键数目以及孤电子对数目,以此判断杂化类型;
中心原子的杂化类型为sp杂化的属于直线形.
单键中只有σ键,双键中有一个σ键和一个π 键,三键中有一个σ键和两个π 键;
分子中孤电子对个数=
| 1 |
| 2 |
根据分子的组成判断形成的δ键数目以及孤电子对数目,以此判断杂化类型;
中心原子的杂化类型为sp杂化的属于直线形.
解答:
解:①CH4中只含有单键为σ键,分子中C原子含有4个σ键电子对,没有孤电子对,杂化类型为sp3,分子构型为正四面体形,属于非极性分子;
②C2H4中含有单键和双键,既有σ键又有π键,分子中C原子含有3个σ键电子对,没有孤电子对,杂化类型为sp2,分子构型为平面形,属于非极性分子;
③H2O中只含有单键为σ键,分子中O原子含有2个σ键电子对和2个孤电子对,杂化类型为sp3,分子构型为V形,属于极性分子;
④NH3中只含有单键为σ键,分子中N原子含有3个σ键电子对和1个孤电子对,杂化类型为sp3,分子构型为三角锥形,属于极性分子;
⑤CH2O中含有单键和双键,既有σ键又有π键,分子中C原子含有3个σ键电子对,没有孤电子对,杂化类型为sp2,分子构型为平面三角形,属于极性分子,
⑥CO2中只含有双键,既有σ键又有π键,分子中C原子含有2个σ键电子对,没有孤电子对,杂化类型为sp,分子构型为直线形,属于非极性分子;
所以非极性分子的是①②⑥;既有σ键又有π键的是②⑤⑥;中心原子没有孤电子对的是①②⑤⑥;中心原子杂化类型为sp3的是 ①③④;分子构型都是直线形的是⑥.
故答案为:①②⑥;②⑤⑥;①②⑤⑥;①③④;⑥.
②C2H4中含有单键和双键,既有σ键又有π键,分子中C原子含有3个σ键电子对,没有孤电子对,杂化类型为sp2,分子构型为平面形,属于非极性分子;
③H2O中只含有单键为σ键,分子中O原子含有2个σ键电子对和2个孤电子对,杂化类型为sp3,分子构型为V形,属于极性分子;
④NH3中只含有单键为σ键,分子中N原子含有3个σ键电子对和1个孤电子对,杂化类型为sp3,分子构型为三角锥形,属于极性分子;
⑤CH2O中含有单键和双键,既有σ键又有π键,分子中C原子含有3个σ键电子对,没有孤电子对,杂化类型为sp2,分子构型为平面三角形,属于极性分子,
⑥CO2中只含有双键,既有σ键又有π键,分子中C原子含有2个σ键电子对,没有孤电子对,杂化类型为sp,分子构型为直线形,属于非极性分子;
所以非极性分子的是①②⑥;既有σ键又有π键的是②⑤⑥;中心原子没有孤电子对的是①②⑤⑥;中心原子杂化类型为sp3的是 ①③④;分子构型都是直线形的是⑥.
故答案为:①②⑥;②⑤⑥;①②⑤⑥;①③④;⑥.
点评:本题考查了分子的极性、σ键和π 键的判断、杂化类型、分子的构型等,题目涉及的知识点较多综合性强,难度中等,注意掌握杂化类型的判断方法.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ |
| B、漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO-3↓+2HClO |
| C、KHSO4熔融状态下电离:KHSO4=K++H++SO42- |
| D、CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
按照一定的依据把物质进行分类,是我们认识物质的组成、结构、性质和用途的便捷途径.姜宇同学在家中建立了小小化学实验室,他收集了许多物质,其中有:①纯碱;②生石灰;③醋酸;④熟石灰;⑤酒精;⑥铜;⑦石墨;⑧氧化铁;⑨蔗糖;⑩尿素.
对上述物质的分类不正确的是( )
对上述物质的分类不正确的是( )
| A、属于有机物的有③⑤⑨⑩ |
| B、属于单质的有⑥⑦ |
| C、属于碱的有①④ |
| D、属于氧化物的有②⑧ |
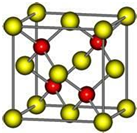 有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:
 某有机物A的结构简式为如图,试回答:
某有机物A的结构简式为如图,试回答: