题目内容
设NA代表阿佛加德罗常数,下列说法正确的是( )
| A、0.2mol过氧化氢完全分解转移的电子数目为0.4 NA |
| B、12.8gCu与足量HNO3反应生成NO和NO2,转移电子数目为0.2 NA' |
| C、1L0.1mol/L的Na2CO3溶液中CO32-的数目小于0.1NA |
| D、将含0.1mol FeCl3的饱和溶液制成胶体后,生成0.1NA个Fe(OH)3胶粒 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、H2O2的分解反应是歧化反应;
B、根据n=
并结合铜元素的化合价来分析;
C、考虑CO32-的水解;
D、1个Fe(OH)3胶粒是多个Fe(OH)3分子的聚集体.
B、根据n=
| m |
| M |
C、考虑CO32-的水解;
D、1个Fe(OH)3胶粒是多个Fe(OH)3分子的聚集体.
解答:
解:A、H2O2的分解反应是歧化反应:2H2O2
2H2↑+O2↑此反应中,1molH2O2转移1mol电子,故0.2mol双氧水要转移0.2mol电子,故A错误;
B、根据n=
可知Cu的物质的量n=
=0.2mol,0.2molCu与足量HNO3反应后变为+2价,转移0.4mol电子即0.4NA个,故B错误;
C、CO32-是弱酸根,会水解,液中CO32-的数目小于0.1NA,故C正确;
D、1个Fe(OH)3胶粒是多个Fe(OH)3分子的聚集体,故0.1mol FeCl3的饱和溶液制成胶体后,Fe(OH)3胶粒的个数小于0.1NA个,故D错误.
故选C.
| ||
| △ |
B、根据n=
| m |
| M |
| 12.8g |
| 64g/mol |
C、CO32-是弱酸根,会水解,液中CO32-的数目小于0.1NA,故C正确;
D、1个Fe(OH)3胶粒是多个Fe(OH)3分子的聚集体,故0.1mol FeCl3的饱和溶液制成胶体后,Fe(OH)3胶粒的个数小于0.1NA个,故D错误.
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用以及物质的具体结构是解题关键,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列关于命名的说法中错误的是( )
| A、所有烃类的命名都应选择含碳原子最多的链作主链,即“最多”原则 |
| B、二甲苯可以以邻、间、对这种习惯方法进行命名 |
| C、二甲苯也可以用系统方法进行命名 |
| D、化学式是C8H10的苯的同系物有4种同分异构体 |
下列实验操作正确的是( )
| A、用托盘天平称量4.00g氢氧化钠固体 |
| B、用10mL量筒量取8.5mL蒸馏水 |
| C、用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
| D、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
Fe(OH)3胶体稳定存在的主要原因是( )
| A、胶粒直径小于1nm |
| B、胶粒做布朗运动 |
| C、胶粒带正电荷 |
| D、胶粒不能透过半透膜 |
下列离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | ||
B、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2AlO
| ||
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | ||
| D、FeCl2溶液中通入足量的Cl2:Fe2++Cl2═Fe3++2Cl- |
下列说法中,可以证明反应N2+3H2?2NH3已达到平衡状态的是( )
①1个N≡N键断裂的同时有3个H-H键形成
②N2、H2、NH3的分子数之比为1:3:2
③1个N≡N键断裂的同时有6个N-H键形成
④N2、H2、NH3的浓度不再变化.
①1个N≡N键断裂的同时有3个H-H键形成
②N2、H2、NH3的分子数之比为1:3:2
③1个N≡N键断裂的同时有6个N-H键形成
④N2、H2、NH3的浓度不再变化.
| A、①④ | B、②③ | C、①③ | D、②④ |
下列有机物的命名正确的是( )
| A、Br-CH2-CH2-Br二溴乙烷: |
B、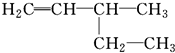 3-乙基-1-丁烯: 3-乙基-1-丁烯: |
C、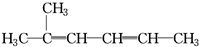 2-甲基-2,4-己二烯: 2-甲基-2,4-己二烯: |
D、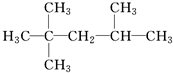 2,2,3-三甲基戊烷: 2,2,3-三甲基戊烷: |
下列物质中,既能与盐酸反应,又能与NaOH溶液反应的是( )
A、 |
B、 |
| C、H2NCH2COONa |
| D、Na2CO3 |
