题目内容
配平下列方程式:
(1)Na2B4O7+Na+H2+SiO2-Na2SiO3+NaBH4
(2)MnO4-+H2O2+H+-Mn2++O2↑+H2O.
(1)Na2B4O7+Na+H2+SiO2-Na2SiO3+NaBH4
(2)MnO4-+H2O2+H+-Mn2++O2↑+H2O.
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:(1)H元素的化合价由0价变为-1价,钠元素的化合价由0价变为+1价,1mol钠变为钠离子,失去1mol电子,1mol氢气得到2mol电子变为H-,再结合原子守恒配平方程式;
(2)反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;H2O2→O2,O由-1价变成0价,一个H2O2分子失去2个电子,所以其最小公倍数为10,故MnO4-的计量数为2,双氧水的计量数为5,然后根据原子守恒配平其它元素.
(2)反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;H2O2→O2,O由-1价变成0价,一个H2O2分子失去2个电子,所以其最小公倍数为10,故MnO4-的计量数为2,双氧水的计量数为5,然后根据原子守恒配平其它元素.
解答:
解:(1)该方程式知,H元素的化合价由0价变为-1价,钠元素的化合价由0价变为+1价,1mol钠变为钠离子,失去1mol电子,1mol氢气得到2mol电子变为H-,再结合原子守恒配平方程式得Na2B4O7+16Na+8H2+7SiO2=7Na2SiO3+4NaBH4,故答案为:Na2B4O7+16Na+8H2+7SiO2=7Na2SiO3+4NaBH4;
(2)反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;H2O2→O2,O由-1价变成0价,一个H2O2分子失去2个电子,所以其最小公倍数为10,故MnO4-的计量数为2,双氧水的计量数为5,然后根据原子守恒配平其它元素,所以其方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O.
(2)反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;H2O2→O2,O由-1价变成0价,一个H2O2分子失去2个电子,所以其最小公倍数为10,故MnO4-的计量数为2,双氧水的计量数为5,然后根据原子守恒配平其它元素,所以其方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O.
点评:本题考查了化学方程式的配平,根据氧化还原反应中得失电子相等,也即根据化合价的升降相等来配平.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有机物A分子式为C2H4,可发生以下系列转化,已知B、D是生活中常见的两种有机物,下列说法不正确的是( )


| A、75%的B溶液常用以医疗消毒 |
| B、D、E都能与NaOH溶液反应 |
| C、B、D、E三种物质可以用饱和Na2CO3溶液鉴别 |
| D、由B、D制备E常用浓H2SO4作脱水剂 |
下列关于Al及其化合物的说法中,正确的是( )
| A、Al2O3可与水反应生成Al(OH)3 |
| B、铝是人类使用最早的金属之一 |
| C、Al2O3是碱性氧化物 |
| D、Al(OH)3沉淀可以溶于盐酸 |
欲除去CaCl2溶液中混有的少量FeCl3,最后加入的试剂为( )
| A、氢氧化钠 | B、氧化钙 |
| C、碳酸钠 | D、碳酸钙 |
与有机物 互为同分异构体,且能与NaOH 溶液反应的化合物有( )
互为同分异构体,且能与NaOH 溶液反应的化合物有( )
 互为同分异构体,且能与NaOH 溶液反应的化合物有( )
互为同分异构体,且能与NaOH 溶液反应的化合物有( )| A、7种 | B、8种 | C、9种 | D、10种 |
下列物质属于含有共价键的离子化合物的是( )
| A、NH4Cl |
| B、Na2O |
| C、Al2O3 |
| D、SO3 |
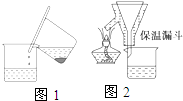 硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下: