题目内容
10.下列有关0.1L 0.1mol/LKMnO4酸性溶液的叙述正确的是( )| A. | 与少量乙二醛混合可制备乙二酸 | |
| B. | 与浓盐酸反应的离子方程式为:2MnO4-+16 H++10Cl-=5Cl2↑+2Mn2++8 H20 | |
| C. | 与K+、NO3-、SO42-、CO32-可以大量共存 | |
| D. | 与过量Na202混合后,共转移e-0.05mol |
分析 A.与少量乙二醛发生氧化还原反应;
B.发生氧化还原反应,遵循电子、电荷守恒;
C.酸性溶液中含氢离子;
D.过氧化钠为还原剂,Mn元素的化合价降低.
解答 解:A.与少量乙二醛发生氧化还原反应生成二氧化碳,故A错误;
B.发生氧化还原反应,遵循电子、电荷守恒,离子反应为2MnO4-+16 H++10Cl-=5Cl2↑+2Mn2++8 H20,故B正确;
C.酸性溶液中含氢离子,不能大量存在CO32-,故C错误;
D.过氧化钠为还原剂,Mn元素的化合价降低,则转移电子为0.01mol×(7-2)=0.05mol,但过氧化钠过量时还u水发生氧化还原反应,则转移电子大于0.05mol,故D错误;
故选B.
点评 本题考查离子的共存及离子反应,为高频考点,把握常见离子之间的反应为解答的关键,侧重氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.A~D六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
请回答下列问题:
(1)A在元素周期表中的位置是第三周期ⅡA族.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(3)用电子式表示MgCl2的形成过程 .
.
| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的1/5 |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
(1)A在元素周期表中的位置是第三周期ⅡA族.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(3)用电子式表示MgCl2的形成过程
 .
.
1.下列离子方程式书写正确的是( )
| A. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 铁与足量的稀盐酸充分反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 将氯气通入氢氧化钠稀溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 氧化铝溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O |
18.下列根据反应原理设计的应用,不正确的是( )
| A. | CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 | |
| B. | Al3++3H2O?Al(OH)3+3H+ 明矾净水 | |
| C. | Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ 制备Fe(OH)3胶体 | |
| D. | SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
15.能正确表示下列反应的离子方程式是( )
| A. | 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2 | |
| B. | 向FeCl3溶液中加Mg(OH)2:3 Mg(OH)2+2Fe3+=2Fe(OH)3+3 Mg2+ | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
2.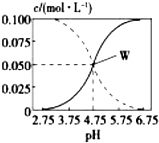 25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列有关该溶液的叙述中正确的是( )
25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列有关该溶液的叙述中正确的是( )
 25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列有关该溶液的叙述中正确的是( )
25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列有关该溶液的叙述中正确的是( )| A. | pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点所表示的溶液中:c(Na+)=c(CH3COOH) | |
| C. | pH=3的溶液中:c(H+)+c(Na+)+c(CH3COOH)=0.1mol/L | |
| D. | 据图象可求得该温度下CH3COOH的电离常数Ka=10-4.75 |
19.下列装置所示的实验能达到目的是( )
| A. |  检验装置气密性 | B. | 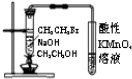 验证溴乙烷发生消去反应生成乙烯 | ||
| C. |  测定中和热 | D. | 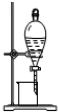 从碘的CCl4溶液中分离出碘 |
2.下列有机物有4种同分异构体的是( )
| A. | 分子式为C4H10的烷烃的二氯取代物 | |
| B. | 分子式为C4H10O2的有机物 | |
| C. | 乙苯的一氯取代物 | |
| D. | 和H2加成生成2-甲基戊烷的单烯烃 |
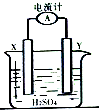 某同学进行如图所示的铜--锌原电池实验,已知电解质溶液中H+向X极移动.
某同学进行如图所示的铜--锌原电池实验,已知电解质溶液中H+向X极移动.