题目内容
1.按要求完成下列问题:(1)甲基的电子式
 (2)乙炔的结构式H-C≡C-H
(2)乙炔的结构式H-C≡C-H(3)相对分子质量为72且沸点最低的烷烃的结构简式C(CH3)4
(4)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
已知:2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
①H2的燃烧热为285.8kJ/mol.
②CH3OH(g)+O2(g)?CO(g)+2H2O(g)的反应热△H=-392.8 kJ/mol.
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)?CH3OH(g),则可用来判断该反应达到平衡状态的标志有AD.(填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与CH3OH的生成速率相等
(5)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1
能使化学反应速率加快的措施有②④(填序号).
①增加C的物质的量 ②升高反应温度
③随时吸收CO、H2转化为CH3OH ④密闭定容容器中充入CO(g)
分析 (1)甲基中含有3个碳氢键,碳原子最外层为7个电子,据此写出甲基的电子式;
(2)乙炔分子中含有一个C≡C;
(3)设烷烃的分子式为CxH(2x+2),根据相对分子质量为72,列出方程式进行计算x值,支链越多,沸点越低;
(4)①燃烧热是1mo可燃物完全燃烧生成稳定氧化物放出的热量,根据盖斯定律及已知热化学方程式得出氢气燃烧热的热化学方程式;
②依据盖斯定律和热化学方程式计算得到;
③根据化学处于平衡时正逆反应速率相等,各组成成分不变,以及有关物理量与平衡移动的关系作判断;
(5)增大物质的浓度、升高温度、使用催化剂、增大气体的压强等均可增大反应速率.
解答 解:(1)甲基中碳原子最外层为7个电子,甲基的电子式为: ,故答案为:
,故答案为: ;
;
(2)乙炔分子中含有一个C≡C,乙炔的结构式H-C≡C-H;故答案为:H-C≡C-H;
(3)设烷烃的分子式为CxH(2x+2),
则14x+2=72,解得x=5,
所以该烷烃的分子式为C5H12,
分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的:CH3CH(CH3)CH2CH3,
主链有3个碳原子的:CH3C(CH3)2CH3;
支链越多,沸点越低,故C(CH3)4,
故答案为:C(CH3)4;
(4)①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1①
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1②,
根据盖斯定律①×$\frac{1}{2}$+②可得:氢气的燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O (l)△H=-285.8kJ/mol,
所以氢气的燃烧热为:△H═-285.8KJ/mol,
故答案为:285.8;
②CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol②,
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol②,
根据盖斯定律②×2-①得到:CH3OH(g)+O2(g)?CO(g)+2H2O(g)△H=-392.8 kJ/mol,
故答案为:-392.8 kJ/mol;
③A.CO百分含量保持不变,说明CO的浓度保持不变,说明处于平衡状态,故A正确;
B.容器中H2浓度与CO浓度相等,并不能代表物质的量不再发生变化,因此不能作为平衡的标志,故B错误;
C.容器的体积不变,气体的质量守恒,所以密度始终不变,因此不能作为平衡的标志,故C错误,
D.CO的生成速率为逆速率,CH3OH的生成速率为正速率,二者相等,说明正逆反应速率相等,说明处于平衡状态,故D正确,
故选AD;
(5)①增加C的物质的量,C为固体,其浓度不变,所以反应速率不变,故错误;
②升高反应温度,反应速率增大,故正确;
③随时吸收CO、H2转化为CH3OH,反应物的浓度减小,则反应速率减小,故错误;
④密闭定容容器中充入CO(g),CO的浓度增大,则反应速率增大,故正确;
故答案为:②④.
点评 本题考查了反应热的计算、盖斯定律的应用、电子式、化学平衡状态的判断、影响反应速率的因素等,题目难度中等,注意掌握热化学方程式的书写原则,明确盖斯定律在反应热计算中的应用,试题培养了学生的分析能力及化学计算能力.

| A. | H2S的电子式: | B. | S2-的结构示意图: | ||
| C. | Na2O2的电子式: | D. | CCl4的电子式: |
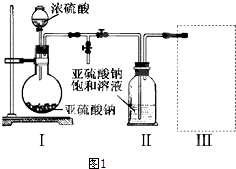
探究一:称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁的价态,同学甲设计如下实验:
现有药品和仪器:药品有:0.1 mol/L KSCN溶液,0.1 mol/L KI溶液,0.2 mol/L酸性高锰酸钾溶液,氯水等;器材有:试管和滴管.
(1)请你设计简单实验,探究上述猜想是否正确,填写下列实验报告.
| 实验步骤 | 操作 | 现象与结论 | 离子方程式 |
| 第一步 | 取少量溶液装于试管,向试管中加入几滴KSCN溶液 | ||
| 第二步 | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe2+ |
(3)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO.
(4)同学丙对同学乙的实验设计提出了质疑,他认为丙中的现象不足以证明NO存在,稍作改进即可.试回答改进措施:
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol/L 酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为:1:3.
(已知2NO2+2NaOH═NaNO3+NaNO2+H2O和NO2+NO+2NaOH═2NaNO2+H2O)
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)═c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)═c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)═c(H+)+c(HS-)+c(H2S) |
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3KJ/mol;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2.
| A. | 16 | B. | 26 | C. | 46 | D. | 50 |
| A. | 碱性:KOH>NaOH | B. | 氧化性:Cl2>S | C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |