题目内容
下列有关溶液组成的描述合理的是( )
| A、无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- |
| B、酸性溶液中可能大量存在Na+、ClO-、SO42-、I- |
| C、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
| D、中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- |
考点:离子共存问题
专题:离子反应专题
分析:A.Al3+与S2-发生互促水解反应;
B.弱酸的阴离子以及能发生氧化还原反应的离子不能大量存在于酸性溶液中;
C.弱碱性离子可存在水解呈碱性的离子;
D.Fe3+水解呈酸性.
B.弱酸的阴离子以及能发生氧化还原反应的离子不能大量存在于酸性溶液中;
C.弱碱性离子可存在水解呈碱性的离子;
D.Fe3+水解呈酸性.
解答:
解:A.溶液无色,但Al3+与S2-发生互促水解反应,不能大量共存,故A错误;
B.弱酸性溶液中ClO-不能大量共存,且ClO-与I-发生氧化还原反应,故B错误;
C.HCO3-水解呈碱性,可存在于弱碱性溶液中,故C正确;
D.Fe3+水解呈酸性,不能存在于中性溶液中,故D错误.
故选C.
B.弱酸性溶液中ClO-不能大量共存,且ClO-与I-发生氧化还原反应,故B错误;
C.HCO3-水解呈碱性,可存在于弱碱性溶液中,故C正确;
D.Fe3+水解呈酸性,不能存在于中性溶液中,故D错误.
故选C.
点评:本题考查离子共存问题,为高频常见题型和高频考点,侧重于学生的分析能力的考查,注意把握离子的性质和反应类型的判断,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为
2Ag+Zn(OH)2
Ag2O+Zn+H2O
此电池充电时,阴极上发生反应的物质是( )
2Ag+Zn(OH)2
| 充电 |
| 放电 |
此电池充电时,阴极上发生反应的物质是( )
| A、Ag |
| B、Zn(OH)2 |
| C、Ag2O |
| D、Zn |
下列各组物质中,只要总质量一定,不论以何种比例混合,完全燃烧,生成的二氧化碳和水的质量也总是定值的是( )
| A、丙烷和丙烯 |
| B、乙醇和乙醚 |
| C、乙烯和丁烯 |
| D、甲烷和乙烷 |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的量浓度、反应速率分别随时间的变化如图所示: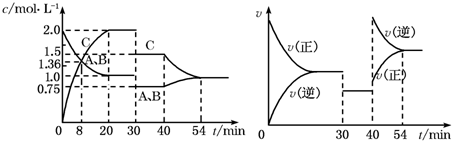
下列说法中正确的是( )

下列说法中正确的是( )
| A、30min~40min间该反应使用了催化剂 |
| B、反应方程式中的x=1,正反应为放热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、8min前A的平均反应速率为0.08mol?L-1?min-1 |
雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
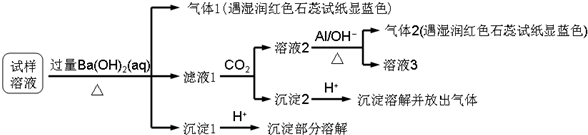
已知:3NO3-+8Al+5OH-+2H2O
3NH3↑+8AlO2-
根据以上的实验操作和现象,该同学得出的结论不正确的是( )

已知:3NO3-+8Al+5OH-+2H2O
| △ |
根据以上的实验操作和现象,该同学得出的结论不正确的是( )
| A、试样中肯定存在NH4+、Mg2+、SO42-和NO3- |
| B、试样中一定不含Al3+ |
| C、试样中可能存在Na+、Cl- |
| D、该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |
m mol C2H2跟n mol HCl在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H3Cl.将反应后的混合气体完全燃烧,生成CO2、H2O和HCl,所需要氧气的物质的量是( )
| A、(3m+n)mol | ||||
B、(
| ||||
C、(3m+n-
| ||||
D、
|
2,2,6,6-四甲基庚烷的一氯取代物的同分异构体共有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
下列说法正确的是( )
| A、金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 |
| B、用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 |
| C、邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小 |
| D、向某溶液中加入茚三铜试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质 |