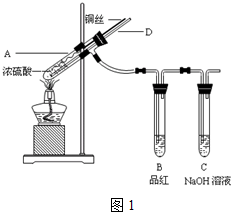
题目内容
2.下列反应的离子方程式正确的是( )| A. | 石英溶于烧碱溶液:SiO2+2OH-═SiO32-+H2O | |
| B. | 氢氧化钠溶液中通入少量的二氧化硫:SO2+OH-═HSO3- | |
| C. | 碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 溴化亚铁溶液中通入少量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
分析 A.反应生成硅酸钠和水;
B.反应生成亚硫酸钠和水;
C.反应生成碳酸钙、碳酸钠和水;
D.少量氯气,只氧化亚铁离子.
解答 解:A.石英溶于烧碱溶液的离子反应为SiO2+2OH-═SiO32-+H2O,故A正确;
B.氢氧化钠溶液中通入少量的二氧化硫的离子反应为SO2+2OH-═SO32-+H2O,故B错误;
C.碳酸氢钙溶液中加入足量氢氧化钠溶液的离子反应为Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O,故C错误;
D.溴化亚铁溶液中通入少量氯气的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及与量有关的离子反应,题目难度不大.

练习册系列答案
相关题目
11.细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺.它主要是应用细菌法溶浸贫矿、废矿、尾矿等,以回收某些贵重有色金属和稀有金属,达到防止矿产资源流失,最大限度地利用矿藏.下列有关细菌冶金的说法中不正确的是( )
| A. | 细菌冶金能充分利用资源和废物,能耗低 | |
| B. | 细菌冶金不产生二氧化硫等有毒气体,环境污染少 | |
| C. | 细菌冶金温度越高,化学反应速率越快,采矿效率越高 | |
| D. | 推广细菌冶金体现了绿色化学理念,有利于经济可持续发展 |
17.下列离子方程式书写正确的是( )
| A. | MgCO3与盐酸反应:CO32-+2H+=CO2↑+2H2O | |
| B. | FeBr2与少量的Cl2反应:Fe2++Cl2=Fe3++2Cl- | |
| C. | 镁与醋酸反应 Mg+2H+=Mg2++H2↑ | |
| D. | NaHCO3与NaOH反应:HCO3-+OH-=CO32-+H2O |
7.将xmol/LH2SO4溶液aml稀释到bL,稀释后溶液的H+物质的量浓度为( )
| A. | ax/100bmol/L | B. | ax/500bmol/L | C. | ax/2000bmol/L |
14.设nA为阿伏伽德罗常数的数值,下列说法正确的是(相对原子质量:H:1,O:16)( )
| A. | 常温常压下,1.7gH2O2中含有的电子数为0.9nA | |
| B. | 1L1 mol.L-1CuCl2溶液含有2nA个Cl- | |
| C. | 1 mol Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去2nA个电子 | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1nA |
12.下列叙述中,不正确的是( )
| A. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| B. | 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 | |
| C. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| D. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
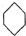 (g)?3H2(g)+
(g)?3H2(g)+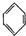 (g)△H1
(g)△H1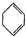 (g)△H2=+28.6KJ/mol
(g)△H2=+28.6KJ/mol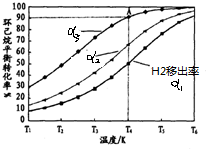
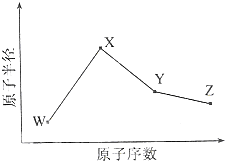 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.