题目内容
13.美国的科学家发现普通盐水在无线电波的照射下可以燃烧,有望解决人类的能源危机.无线电频率可以降低盐水中所含元素之间的结合力,释放出氢气,一旦点火,氢气就会在这种频率下持续燃烧.上述“盐水中所含元素之间的结合力”是指( )| A. | Na+与Cl-之间的离子键 | B. | 水分子间的氢键 | ||
| C. | 水分子内的共价键 | D. | 上述所有作用力 |
分析 盐水中含有氯化钠和水,无线电频率可以降低盐水中所含元素之间的结合力,释放出氢气,说明是破坏水分子中O-H键而生成氢气,据此分析解答.
解答 解:盐水中含有氯化钠和水,无线电频率可以降低盐水中所含元素之间的结合力,释放出氢气,有新物质生成,说明发生化学反应,根据元素守恒知,应该是破坏水分子中O-H键而生成氢气,与氯化钠中的离子键、水分子之间的氢键都无关,故选C.
点评 本题考查化学键,为高频考点,侧重考查学生获取信息及自学能力,正确从微观结构分析解答是解本题关键,题目难度中等.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
8.对于某些离子的检验及结论正确的是( )
| A. | 加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32- | |
| B. | 加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42- | |
| C. | 某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+ | |
| D. | 某溶液的焰色反应为黄色,则该溶液中一定有Na+ |
9.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 若将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| B. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前<N后 |
18. 最近索尼公司演示了一种电池,可以采用碎纸运行,产生的废弃物就是水.该电池的电解质溶液中混合了水和酶,酶分解纸张会产生氢离子,氢离子与空气结合产生水,从而形成电流.其结构示意图如图所示,关于该电池的叙述正确的是( )
最近索尼公司演示了一种电池,可以采用碎纸运行,产生的废弃物就是水.该电池的电解质溶液中混合了水和酶,酶分解纸张会产生氢离子,氢离子与空气结合产生水,从而形成电流.其结构示意图如图所示,关于该电池的叙述正确的是( )
 最近索尼公司演示了一种电池,可以采用碎纸运行,产生的废弃物就是水.该电池的电解质溶液中混合了水和酶,酶分解纸张会产生氢离子,氢离子与空气结合产生水,从而形成电流.其结构示意图如图所示,关于该电池的叙述正确的是( )
最近索尼公司演示了一种电池,可以采用碎纸运行,产生的废弃物就是水.该电池的电解质溶液中混合了水和酶,酶分解纸张会产生氢离子,氢离子与空气结合产生水,从而形成电流.其结构示意图如图所示,关于该电池的叙述正确的是( )| A. | 该电池属于燃料电池 | |
| B. | 该电池可在高温下使用 | |
| C. | a为该电池的负极 | |
| D. | b极附近的电极反应为:(C6H10O5)π+7nH2O+24ne-=6nCO2+24nH+ |
5.现有CaCO3、BaCO3的混合矿石粉末,为了制得纯净的CaCO3和纯净BaCO3,从有关资料中查得有关溶解度数据和工艺流程如下:
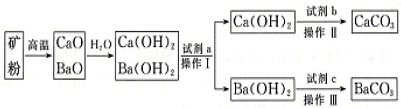
(1)将矿粉变为CaO、BaO的混合物通常采用焦炭作为能源,从经济效益的角度考虑,除焦炭价格便宜意外,还有一个重要原因是利用焦炭燃烧产生的高温使矿石分解,有关反应为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑,上述反应生成的二氧化碳经净化后,可用作制取纯净CaCO3、BaCO3的原料.
(2)试剂a是水(填名称),操作Ⅰ的具体操作过程是将混合液升温至80℃,析出Ca(OH)2,过滤得到Ca(OH)2固体和Ba(OH)2溶液.
(3)试剂b与试剂c是否是同一物质?否(填“是”或“否”),写出加入试剂c后发生反应的离子方程式:CO2+Ba2++2OH-=BaCO3↓+H2O.
| 0℃ | 50℃ | 80℃ | |
| Ca(OH)2 | 0.173g | 0.13g | 0.094g |
| Ba(OH)2•8H2O | 1.64g | 13.2g | 101.4g |

(1)将矿粉变为CaO、BaO的混合物通常采用焦炭作为能源,从经济效益的角度考虑,除焦炭价格便宜意外,还有一个重要原因是利用焦炭燃烧产生的高温使矿石分解,有关反应为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑,上述反应生成的二氧化碳经净化后,可用作制取纯净CaCO3、BaCO3的原料.
(2)试剂a是水(填名称),操作Ⅰ的具体操作过程是将混合液升温至80℃,析出Ca(OH)2,过滤得到Ca(OH)2固体和Ba(OH)2溶液.
(3)试剂b与试剂c是否是同一物质?否(填“是”或“否”),写出加入试剂c后发生反应的离子方程式:CO2+Ba2++2OH-=BaCO3↓+H2O.
2.有一放置在空气中的KOH固体,经测定,其中含 KOH 84.9%,KHCO3 5.1%,K2CO3 2.38%,H2O 7.62%.将此样品若干克投入 98克10%的盐酸中,待反应完全后,再需加入20克10%的KOH溶液方能恰好中和.则蒸发中和后的溶液可得固体质量为( )
| A. | 20克 | B. | 40克 | C. | 48克 | D. | 36克 |
3.某温度下反应H2(g)+I2(g)?2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2mol•L-1H2(g)、0.5mol•L-1 I2(g)及0.3mol•L-1 HI(g),则下列说法中正确的是( )
| A. | 反应总体向左进行 | |
| B. | 反应达到平衡时,H2的物质的量分数<50% | |
| C. | 反应向某方向进行一段时间后K<57.0 | |
| D. | 反应达到平衡时,H2的转化率为75% |