题目内容
10.实验室盛放氢氧化钠的试剂瓶应贴有的安全使用标识是( )| A. |  | B. |  | C. |  | D. |  |
分析 氢氧化钠具有强烈腐蚀性,结合图中所示标志的含义进行分析判断即可.
解答 解:氢氧化钠具有强烈的腐蚀性,应贴腐蚀品标志,
A.图中所示标志是腐蚀品标志,故A选;
B.图中所示标志是易燃物品标志,故B不选;
C.图中所示标志是自燃物品标志,故C不选;
D.图中所示标志是有毒品标志,故D不选;
故选:A.
点评 本题难度不大,解答本题首先要知道各个图标所代表的含义,然后根据氢氧化钠的性质进行分析判断.

练习册系列答案
相关题目
9.苯环实际上不具有碳碳单键和双键的交替结构,可以作为证据的事实有( )
①苯的间位二取代物只有一种
②苯的邻位二取代物只有一种
③苯分子中碳碳键的键长均相等
④苯不能使酸性KMnO4溶液褪色
⑤苯在加热和催化剂存在条件下,与氢气发生加成反应
⑥苯在FeBr3存在的条件下,与液溴发生取代反应,但不能因化学变化而使溴水褪色.
①苯的间位二取代物只有一种
②苯的邻位二取代物只有一种
③苯分子中碳碳键的键长均相等
④苯不能使酸性KMnO4溶液褪色
⑤苯在加热和催化剂存在条件下,与氢气发生加成反应
⑥苯在FeBr3存在的条件下,与液溴发生取代反应,但不能因化学变化而使溴水褪色.
| A. | ①②③④ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | 全部 |
1.研究小组同学对金属镁与NH4Cl溶液的反应产生了浓厚的兴趣.可供选择的实验试剂为:镁粉,1mol/L NH4Cl溶液,1mol/L盐酸溶液,1.0mol/LCH3COONH4溶液,1.0mol/LKNO3溶液,1.0mol/LNaCl溶液
(1)研究小组做了如下几组实验,请完成下面表格(表中不要留空格):
从实验结果得知,常温下镁几乎不和水反应,却很容易与NH4Cl,NH4NO3溶液反应产生气体,实验②的目的是验证铵根离子能和镁反应,但同学们认为这个方案还应该补充:NaNO3溶液与镁作用.
(2)研究小组提出如下猜测:
假设一:NH4+是这个反应的催化剂,能促进水和镁反应:
假设二:Cl-是镁和水反应的催化剂;
假设三:NH4+水解溶液呈酸性…
请写出NH4Cl水解反应离子反应方程式:NH4++H2O?NH3•H2O+H+.
(3)研究小组发现除了生产氢气外,还生成了能使湿润的红色石蕊试纸测变蓝的气体.请简写出用试纸测试气体的过程取湿润的红色石蕊试纸粘在玻璃棒上,靠近出气口,试纸变蓝,说明生成氨气(4)为验证假设二,请你设计一个实验方案,写出实验步骤和结论.
(1)研究小组做了如下几组实验,请完成下面表格(表中不要留空格):
| 编号 | 镁粉/g | H2O/mL | NH4Cl溶液/mL | NH4NO3溶液/mL |
| ① | 5 | 0 | 20 | 0 |
| ② | 5 | 0 | 0 | 20 |
| ③ | 5 | 20 | 0 | 0 |
(2)研究小组提出如下猜测:
假设一:NH4+是这个反应的催化剂,能促进水和镁反应:
假设二:Cl-是镁和水反应的催化剂;
假设三:NH4+水解溶液呈酸性…
请写出NH4Cl水解反应离子反应方程式:NH4++H2O?NH3•H2O+H+.
(3)研究小组发现除了生产氢气外,还生成了能使湿润的红色石蕊试纸测变蓝的气体.请简写出用试纸测试气体的过程取湿润的红色石蕊试纸粘在玻璃棒上,靠近出气口,试纸变蓝,说明生成氨气(4)为验证假设二,请你设计一个实验方案,写出实验步骤和结论.
| 实验步骤(不要求写出具体操作过程): 增加一组镁与NaCl溶液的作用的实验 实验结论常温下镁几乎不和NaCl溶液反应 |
5.将m g含Fe2O3•nH2O的Al2O3溶于200mL 0.05mol/L的硫酸溶液中,然后加入100mLNH3•H2O,使溶液的Fe3+和Al3+恰好完全沉淀,则NH3•H2O的浓度为( )
| A. | 0.2mol/L | B. | 0.1mol/L | C. | 0.05mol/L | D. | 0.02 mol/L |
2.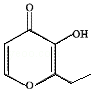 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C7H7O3 | |
| B. | 1mol该有机物最多能与2mol H2发生加成反应 | |
| C. | 该有机物能发生取代、加成和氧化反应 | |
| D. | 该有机物的一种含苯环的同分异构体能发生银镜反应 |
19.在容积不变的密闭容器中存在如下反应:2A(g)+B(s)?2C(g)△H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )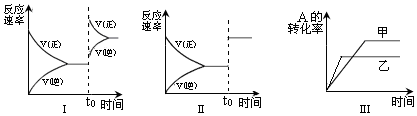

| A. | 图I研究的是t0时刻增大A的浓度对反应速率的影响 | |
| B. | 图II研究的是t0时刻加入催化剂或通入氦气使压强增大后对反应速率的影响 | |
| C. | 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高 | |
| D. | 图III研究的是温度对化学平衡的影响,且乙的温度较高 |
20.德国化学家F.Haber利用N2和 H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的微观历程及能量变化的示意图如下,用 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )

 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
| A. | 催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 | |
| D. | 使用催化剂,合成氨反应放出的热量减少 |
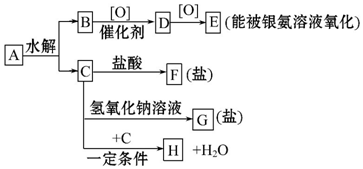
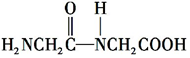 +H2O.
+H2O.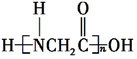 +(n-1)H2O.
+(n-1)H2O.