题目内容
14. 周期表中前四周期元素R、W、X、Y、Z 的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z 的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:(1)写出Z的基态原子外围电子排布3d104s1.
(2)R的某种钠盐晶体,其阴离子Am-(含R、W、氢三种元素)的球棍模型如图所示:在Am-中,R原子轨道杂化类型有SP2、SP3;m=2.(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原子所构成的立体几何构型为正八面体.
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]SO4,下列说法正确的是AD.
A.[Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(NH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.[Z(NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为四面体
(5)固体YCl5的结构实际上是YCl4+和YCl6-构成的离子晶体,其晶体结构与CsCl相似.若晶胞边长为apm,则晶胞的密度为$\frac{417×1{0}^{30}}{{a}^{3}{N}_{A}}$g•cm-3.(已知阿伏伽德罗常数为NA,用含a和NA的代数式表示)
分析 R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1,及p能级只有1个电子,R原子核外电子排布为1s22s22p1,故R为硼元素;Y元素原子的3p能级处于半充满状态,Y原子的核外电子排布为1s22s22p63s23p3,故Y为磷元素;W的氢化物的沸点比同族其它元素氢化物的沸点高,考虑氢键的存在,且X2+与W2-具有相同的电子层结构,故X处于第三周期、W处于第二周期,故X为Mg元素、W为氧元素;Z+的电子层都充满电子,各层电子数为2、8、18,故Z原子核外电子数为2+8+18+1=29,故Z为Cu元素,据此解答.
解答 解:R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1,及p能级只有1个电子,R原子核外电子排布为1s22s22p1,故R为硼元素;Y元素原子的3p能级处于半充满状态,Y原子的核外电子排布为1s22s22p63s23p3,故Y为磷元素;W的氢化物的沸点比同族其它元素氢化物的沸点高,考虑氢键的存在,且X2+与W2-具有相同的电子层结构,故X处于第三周期、W处于第二周期,故X为Mg元素、W为氧元素;Z+的电子层都充满电子,各层电子数为2、8、18,故Z原子核外电子数为2+8+18+1=29,故Z为Cu元素,
(1)Z为Cu元素,原子核外电子数为29,原子核外电子排布式为1s22s22p63s23p63d104s1,Cu的基态原子的外围电子排布式为3d104s1,
故答案为:3d104s1;
(2)H原子成1个键,O原子成2个键,B原子一般是形成3个键,B形成4个键,其中1个键很可能就是配位键,则成3个键的B原子为SP2杂化,成4个键的B为SP3杂化;
观察模型,可知Am-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,
故答案为:SP2、SP3;2;
(3)经X射线探明,Mg与O形成化合物的晶体结构与NaCl的晶体结构相似,Mg2+的周围有6个O原子,为如图结构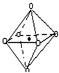 ,故配位原子所构成的立体几何构型为正八面体,
,故配位原子所构成的立体几何构型为正八面体,
故答案为:正八面体;
(4)A.[Z(NH3)4]SO4中,内界离子[Cu(NH3)4]2+与外界离子SO42形成离子键,Cu2+与NH3形成配位键,NH3中N原子与H原子之间形成极性键,故A正确;
B.在[Z(NH3)4]SO4中Z2+提供空轨道,NH3给出孤对电子,故B错误;
C.[Z(NH3)4]SO4组成元素中第一电离能最大的是N元素,故C错误;
D.SO42-与PO43-互为等电子体,价层电子总数相同,空间结构相同,SO42-中S原子成4个σ键,孤对电子对数为$\frac{6+2-4×2}{2}$=0,价层电子对为4,为正四面体,故D正确;
故答案为:AD;
(5)固体PCl5的结构实际上是PCl4+和PCl6-构成的离子晶体,其晶体结构与CsCl相似,则晶胞的组成为P2Cl10,晶胞中相当于含有2个PCl5,若晶胞边长为apm,则晶胞的密度为$\frac{\frac{208.5g/mol}{{N}_{A}mo{l}^{-1}}×2}{(a×1{0}^{-10}cm)^{3}}$=$\frac{417×1{0}^{30}}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:$\frac{417×1{0}^{30}}{{a}^{3}{N}_{A}}$.
点评 本题考查核外电子排布规律、配合物、杂化轨道、晶胞结构与计算等,难度较大,侧重于考查学生的分析能力、对基础知识的综合应用能力和计算能力,注意把握杂化类型的判断方法和晶胞的计算方法.


部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
(2)滤渣A的成分除MnO2外,还有Fe(OH)3和Al(OH)3.
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2.工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,当阴极产生4.48L(标况)气体时,MnO2的理论产量为17.4g.
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是Mn(OH)2>MnCO3>MnS(填写化学式).
(1)探究铁矿石中铁元素的价态
①提出假设:
假设一:该铁矿石中铁元素的价态为+2;
假设二:该铁矿石中铁元素的价态为+3;
假设三:该铁矿石中铁元素的价态为+2和+3.
②设计实验方案:
为了确定该铁矿石中铁元素的价态,甲同学设计了如下实验方案,请你利用限选试剂帮他完成该探究过程.限选试剂:1mol?L-1H2SO4溶液、3%双氧水溶液、2mol?L-1HNO3溶液、0.01mol?L-1高锰酸钾溶液、1mol?L-1NaOH溶液、0.1mol?L-1KI溶液、0.01mol?L-1KSCN溶液、蒸馏水.
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量样品于试管中,滴加适量的1mol?L-1H2SO4溶液,加热溶解,得到A溶液 | |
| 步骤2: | 若高锰酸钾溶液紫红色褪去,则样品中含+2价的铁元素 |
| 步骤3: | 若溶液变红色,则样品中含+3价的铁元素 |
乙同学设计了如下实验方案:取少量样品于试管中,滴加适量的2mol?L-1HNO3溶液,加热溶解,得到B溶液,取少量B溶液于试管中,向其中滴加几滴0.01mol?L-1KSCN溶液,溶液变红色,说明该铁矿石中铁元素的价态为+3.你认为此结论错误(填“正确”或“错误”),其理由是稀硝酸具有强氧化性,能将样品中+2价的铁氧化为+3价的铁.
(2)探究铁矿石中铁的含量
将2.25g该铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL;现利用0.02mol?L-1酸性高锰酸钾溶液对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液于锥形瓶中,用已配制的0.02mol?L-1酸性高锰酸钾溶液进行滴定,判断达到滴定终点的方法是滴加最后一滴酸性高锰酸钾溶液时,溶液由浅黄色突然变为红色,且半分钟内不再变为无色,即达到滴定终点.
②重复此滴定操作2~3次,平均消耗酸性高锰酸钾溶液21.50mL,则该铁矿石中铁元素的质量分数为53.5%.
| A. | 配制一定物质的量浓度的溶液时,定容时俯视刻度线会导致所配溶液浓度偏低 | |
| B. | 用托盘天平称取25.20 g NaCl | |
| C. | 用100 mL的量筒量取5.2 mL的盐酸 | |
| D. | 用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线读数会导致所配溶液浓度偏高 |
①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2 ⑤Na2SiO3.
| A. | ①③④ | B. | ②③④ | C. | ①②③⑤ | D. | ①②③④ |
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
| A. | 若a=b,则混合后溶液中一定有:c(X-)=c(Y+)>c(H+)=c(OH-) | |
| B. | 若m+n=14,则混合后溶液一定显中性 | |
| C. | 若混合后溶液中c(X-)<c(Y+),则该混合溶液一定显碱性 | |
| D. | 若a=b,混合后溶液pH<7,则混合溶液中一定存在:c(Y-)=c(X-)+c(HX) |

