题目内容
7.乙醇与6.0g某饱和一元羧酸A恰好反应,生成酯8.8g,则A的相对分子质量60.分析 设饱和一元酸为R-COOH,与乙醇发生R-COOH+CH3CH2OH→R-COOCH2CH3+H2O,结合根据质量关系结合方程式计算.
解答 解;设饱和一元酸为R-COOH,与乙醇发生R-COOH+CH3CH2OH→R-COOCH2CH3+H2O,则
M( R)+45 M(R)+73
6.0 8.8
则 (M( R)+45)×8.8=6.0×(M(R)+73 )
M(R)=15,
则A的相对分子质量为15+45=60,
故答案为:60.
点评 本题考查根据方程式进行的计算,为高频考点,侧重考查学生的分析、计算能力,比较基础,清楚发生的反应是解题关键,有利于学生对基础知识的巩固.

练习册系列答案
相关题目
20.T℃时,向10L容积不变的密闭容器中加入1.0mol NH2COONH4,发生反应NH2COONH4(s)?CO2(g)+2NH3(g)△H>0,5min达到平衡,测得容器中NH2COONH4(s)的物质的量为0.2mol,下列说法正确的是( )
| A. | 0~5min内,v(CO2)=0.16mol•L-1•min-1 | |
| B. | 氨气体积分数不变时,该反应一定达到平衡状态 | |
| C. | 平衡后,缩小容器容积,重新建立平衡时,c(CO2)增大 | |
| D. | 其他条件不变,若将原容器改为绝热容器,则达到平衡时,NH2COONH4的转化率小于80% |
18.下列物质属于电解质的是( )
| A. | CO2 | B. | Ca(OH)2 | C. | 食盐水 | D. | 石墨 |
15.观察氯化钠在水中的电离示意图,可获得很多信息,其中不正确的是( )

①Na+和Cl-的半径不同
②水分子中氢和氧的半径不同
③Na+和Cl-周围的水分子数不同
④环绕在Na+和Cl-周围的水分子的排列方式相同
⑤物质的溶解是在水分子的作用下完成的
⑥溶于水的NaCl不完全电离
⑦离子在水溶液中是以水合离子的形式存在的.

①Na+和Cl-的半径不同
②水分子中氢和氧的半径不同
③Na+和Cl-周围的水分子数不同
④环绕在Na+和Cl-周围的水分子的排列方式相同
⑤物质的溶解是在水分子的作用下完成的
⑥溶于水的NaCl不完全电离
⑦离子在水溶液中是以水合离子的形式存在的.
| A. | ④⑥ | B. | ①②③ | C. | ④⑤⑦ | D. | ①③④⑥ |
2.设NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 1L1mol/L的盐酸溶液中,所含HCl分子数为NA | |
| B. | 常温常压下,71gCl2溶于水,转移的电子数目为0.1NA | |
| C. | 标准状况下,22.4LSO2和SO3的混合物,含硫原子的数目为NA | |
| D. | 0.5mol乙醇中含有的极性共价键数目为3.5NA |
12.分子式为C4H8ClBr的有机物共有(不含立体异构)( )
| A. | 15种 | B. | 14种 | C. | 13种 | D. | 12种 |
19.下列实验不能达到实验目的或者实验操作不正确的是( )
| A. | 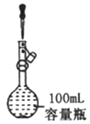 定容 | |
| B. | 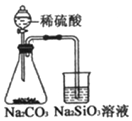 比较硫、碳、硅三种元素的非金属性强弱 | |
| C. | 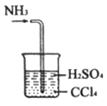 处理尾气 | |
| D. | 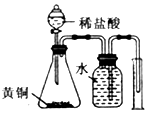 测定黄铜(Cu、Zn合金)中Zn的含量 |
16.aW、bX、cC、dZ、eR是五种短周期元素,e-d=d-c=c-b=b-a=4,其中一种是常见金属,下列有关说法不正确的是( )
| A. | Z为金属 | |
| B. | WY比WR稳定 | |
| C. | X的最高价氧化物对应的水化物为弱酸 | |
| D. | XR3是离子化合物 |
18.下列关于元素及其化合物的说法不正确的是( )
| A. | Fe在一定条件下可与浓盐酸、稀硫酸、浓硝酸等剧烈反应 | |
| B. | Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用不相同 | |
| C. | 在稀硫酸中加入铜粉,铜粉不溶解,若再继续加入KNO3固体,铜粉会溶解 | |
| D. | 金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱 |