题目内容
16.下列说法正确的是( )| A. | 稀释Na2CO3溶液时,$\frac{c(HC{{O}_{3}}^{-}•c(O{H}^{-}))}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 常温下,反应4Fe(OH)2(s)+2H2O(I)+O2(g)═4Fe(OH)3(s)的△H<0,△S<0 | |
| C. | 用0.1mol•L-1CH3COOH溶液滴定0.1mol•L-1 NaOH至中性时:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小 |
分析 A.平衡常数仅与温度有关;
B.该反应能自发进行,且△S<0,应满足△H-T•△S<0,据此判断焓变值.
C.根据溶液的电中性判断;
D.水的离子积只受温度的影响.
解答 解:A.$\frac{c(HC{{O}_{3}}^{-}•c(O{H}^{-}))}{c(C{{O}_{3}}^{2-})}$为碳酸钠的水解平衡常数,平衡常数仅与温度有关,稀释时常数不变,故A错误;
B.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,应满足△H-T•△S<0,该反应为熵减反应,即△S<0,说明是放热反应,△H<0,故B正确;
C.溶液中存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),至中性时c(Na+)=c(CH3COO-),故C错误;
D.水的离子积只受温度的影响,加入盐酸或氢氧化钠,水的离子积不变,故D错误.
故选B.
点评 本题考查了水解平衡常数及影响水解平衡的因素.为高频考点,侧重考查学生的分析能力,注意水解平衡常数和化学平衡常数一样是温度的函数,与条件无关.化学平衡移动原理同样适合水解平衡的移动,要多迁移,多联系.

练习册系列答案
相关题目
6.表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾能力强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可为航天员供氧 | Na2O2能与CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
7.下列各图示与对应的描述相符合的是( )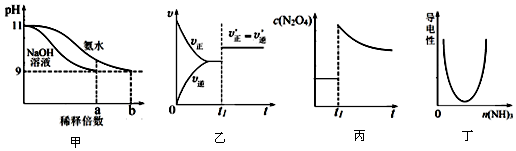

| A. | 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100 | |
| B. | 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂 | |
| C. | 图丙表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| D. | 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
11.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 2L 1mol/L过氧化氢溶液中含氧原子数为4NA | |
| B. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| C. | 2mol MnO2与足量的浓盐酸加热充分反应,转移电子数为4NA | |
| D. | 密闭容器中2molNO2和1molO2充分反应,产物分子数为2NA |
1.在浓度均为1mol•L-1的(NH4)2SO4和NH4Cl两种溶液中,NH4+的水解程度分别为a1,a2,NH4+的浓度分别为c1,c2,则( )
| A. | a1>a2,c1>c2 | B. | a1<a2,c1<c2 | C. | a1>a2,c1<c2 | D. | a1<a2,c1>c2 |
6.有一真空瓶充入空气后质量为m1,在相同状况下,若改为充入某气体A时,总质量为m2,且m2>m1,则气体A可能是( )
| A. | H2 | B. | N2 | C. | O2 | D. | CO |
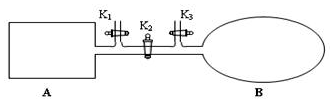 我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.
我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L. .
.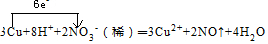 .
.
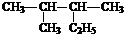 2,3-二甲基戊烷
2,3-二甲基戊烷