题目内容
能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
回答下列问题
(1)写出能表示H2燃烧热的热化学方程式 .
(2)已知C(s)+H2O(g)?H2(g)+CO(g)△H═ kJ/moL;
(3)估算出C=O键能为 kJ/moL;
(4)CH4的燃烧热△H=- kJ/moL;
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为 mol[保留到小数点后2位;已知:c (H2O)═4.2J/(g?℃)].
| ① | H2(g)+O2(g)═H2O(g)△H═-242kJ/mol; |
| ② | 2H2(g)+O2(g)═2H2O(l)△H═-572kJ/mol; |
| ③ | C(s)+O2(g)═CO(g)△H═-110.5kJ/moL; |
| ④ | C(s)+O2(g)═CO2(g)△H═-393.5kJ/moL; |
| ⑤ | CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL |
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
(1)写出能表示H2燃烧热的热化学方程式
(2)已知C(s)+H2O(g)?H2(g)+CO(g)△H═
(3)估算出C=O键能为
(4)CH4的燃烧热△H=-
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为
考点:热化学方程式,有关反应热的计算,反应热和焓变
专题:化学反应中的能量变化
分析:(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物的过程中放出的热量分析书写;
(2)依据热化学方程式①③结合盖斯定律计算得到所需热化学方程式;
(3)依据反应⑤的反应焓变,结合焓变=反应物键能总和-生成物键能总和;
(4)燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物的过程中放出的热量,结合①②⑤热化学方程式和盖斯定律计算;
(5)根据题意求出的甲烷燃烧热计算CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%时放出的热量,再根据水烧开需要的热量计算需要甲烷的物质的量.
(2)依据热化学方程式①③结合盖斯定律计算得到所需热化学方程式;
(3)依据反应⑤的反应焓变,结合焓变=反应物键能总和-生成物键能总和;
(4)燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物的过程中放出的热量,结合①②⑤热化学方程式和盖斯定律计算;
(5)根据题意求出的甲烷燃烧热计算CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%时放出的热量,再根据水烧开需要的热量计算需要甲烷的物质的量.
解答:
解:(1)燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物的过程中放出的热量,表示H2燃烧热的热化学方程式H2(g)+
O2(g)═H2O(l)△H═-286kJ/mol;
故答案为:H2(g)+
O2(g)═H2O(l)△H═-286kJ/mol;
(2)①H2(g)+O2(g)═H2O(g)△H═-242kJ/mol;③C(s)+O2(g)═CO(g)△H═-110.5kJ/moL;
依据热化学方程式结合盖斯定律计算③-①C(s)+H2O(g)?H2(g)+CO(g)△H═+131.5kJ/moL
故答案为:+131.5;
(3)CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL,设C=O键能为x,
反应焓变△H=反应物键能总和-生成物键能总和=2x+2×2×463KJ/mol-(4×414KJ/mol+2×497KJ/mol)=802KJ/mol
x=800KJ/mol;
故答案为:800;
(4)①H2(g)+
O2(g)═H2O(g)△H═-242kJ/mol;
②2H2(g)+O2(g)═2H2O(l)△H═-572kJ/mol;
③CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL
[①×2-②]-③,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol;
故答案为:890;
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量设为x,依据甲烷的燃烧热CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol,计算得到:
90%×890KJ/mol×70%=1000g×4.2×10-3KJ/g?℃×(100-25)℃×x
x=0.56
故答案为:0.56.
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(2)①H2(g)+O2(g)═H2O(g)△H═-242kJ/mol;③C(s)+O2(g)═CO(g)△H═-110.5kJ/moL;
依据热化学方程式结合盖斯定律计算③-①C(s)+H2O(g)?H2(g)+CO(g)△H═+131.5kJ/moL
故答案为:+131.5;
(3)CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL,设C=O键能为x,
反应焓变△H=反应物键能总和-生成物键能总和=2x+2×2×463KJ/mol-(4×414KJ/mol+2×497KJ/mol)=802KJ/mol
x=800KJ/mol;
故答案为:800;
(4)①H2(g)+
| 1 |
| 2 |
②2H2(g)+O2(g)═2H2O(l)△H═-572kJ/mol;
③CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL
[①×2-②]-③,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol;
故答案为:890;
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量设为x,依据甲烷的燃烧热CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol,计算得到:
90%×890KJ/mol×70%=1000g×4.2×10-3KJ/g?℃×(100-25)℃×x
x=0.56
故答案为:0.56.
点评:本题考查了热化学方程式书写方法和盖斯定律计算应用,键能和焓变的计算关系应用,水的热容计算判断,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各组离子,在强酸性溶液中可以大量共存的是( )
| A、K+、Fe2+、SO42-、Br- |
| B、Na+、Al(OH)4-、Cl-、SO42- |
| C、Mg2+、Ca2+、HCO3-、Cl- |
| D、Fe2+、Ca2+、Cl-、NO3- |
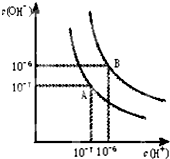 (1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
(1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),