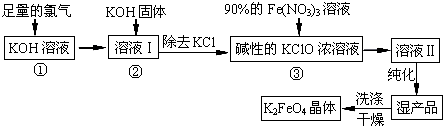
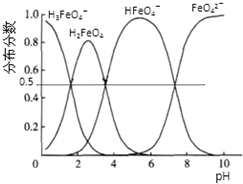
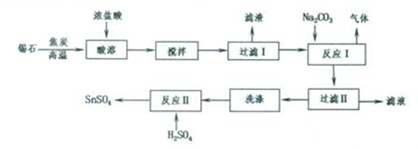
题目内容
8. 将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4•H2O•SO42-
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4•H2O•SO42-(1)Cu2+基态核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9;空间构型为正四面体.(用文字描述)
(2)乙醇分子中氧原子轨道杂化类型为sp3.与NH3互为等电子体的一种阳离子为H3O+(填化学式).
(3)1mol[Cu(NH3)4]2+中σ键的数目为16NA.
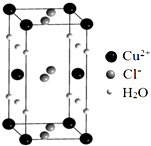
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是CuCl2•2H2O.
分析 (1)Cu原子核外电子排布为1s22s22p63s23p63d104s1,4s与3d能级各失去1个电子形成Cu2+;4个N与Cu2+形成配位键,杂化轨道数目为4,空间构型为正四面体;
(2)乙醇分子中O原子形成2个σ键,含有2对孤对电子,杂化轨道数目为4;原子数目相等、价电子总数相等的微粒互为等电子体;
(3)1个配离子中,4个N与Cu2+形成4条σ键,N、H间形成3×4=12条,共16条;
(4)根据均摊法计算晶胞中Cu2+、H2O数目,结合化合价代数和为0计算晶胞中Cl-离子数目,进而确定化学式.
解答 解:(1)Cu原子核外电子排布为1s22s22p63s23p63d104s1,4s与3d能级各失去1个电子形成Cu2+,Cu2+基态核外电子排布式为1s22s22p63s23p63d9,N原子含有孤对电子,与Cu2+形成配位键,4个N与Cu2+形成配位键,杂化轨道数目为4,空间构型为正四面体,
故答案为:1s22s22p63s23p63d9或[Ar]3d9;正四面体;
(2)乙醇分子中O原子形成2个σ键,含有2对孤对电子,杂化轨道数目为4,氧原子杂化方式为sp3;原子数目相等、价电子总数相等的微粒互为等电子体,与NH3互为等电子体的一种阳离子为H3O+,
故答案为:sp3;H3O+;
(3)1个配离子中,4个N与Cu2+形成4条σ键,N、H间形成3×4=12条,共16条,1mol[Cu(NH3)4]2+中σ键的物质的量16mol,数目为16NA,
故答案为:16NA;
(4)晶胞中Cu2+离子数目为8×$\frac{1}{8}$+2×$\frac{1}{2}$=2、化合价代数和为0,则晶胞中Cl-离子数目为4,H2O数目为8×$\frac{1}{4}$+4×$\frac{1}{2}$=4,该物质化学式为:CuCl2•2H2O,
故答案为:CuCl2•2H2O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物、杂化轨道、等电子体、晶胞计算等,(4)为易错点,图示中氯离子位置不易确定,利用化合价代数和为0确定晶胞中氯离子数目,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | CO2(HCl):碳酸钠溶液 | B. | Cl2(HCl):通过饱和食盐水 | ||
| C. | Na2CO3(NaHCO3):加热固体 | D. | N2(O2):灼热的铜网 |
| A. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L CO2气体中含有氧原子数为0.5NA | |
| C. | 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA | |
| D. | 0.1L 0.5mol•L-1 CH3COOH溶液中含有的H+数为0.05NA |
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
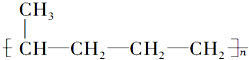 的是( )
的是( )| A. | CH3CH═CH2和CH4 | B. | 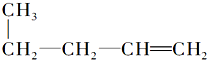 | ||
| C. | CH3CH═CH2和CH4═CH2 | D. | 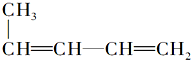 |
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,可看到有氢气生成 | |
| B. | 将除去氧化膜的相同大小、相同质量的镁条和铝条与相同浓度NaOH溶液反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 大理石和盐酸反应制取CO2,增加大理石的用量可加快反应速率 |
| A. | 常温常压下,22.4L O2所含的原子数为2NA | |
| B. | 标准状况下,22.4L H2所含的分子数为NA | |
| C. | 标准状况下,22.4L H2O所含的分子数为NA | |
| D. | 56g铁粉与盐酸完全反应时转移电子数为3NA |