题目内容
反应2X(g)+Y(s)?2Z(g)△H<0,达到平衡时,下列说法正确的是( )
| A、减小容器体积,平衡不移动 |
| B、增大Y的量,Z的百分含量增大 |
| C、加入催化剂,X的转化率增大 |
| D、降低温度,正反应速率增大、逆反应速率减小 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A.该反应在反应前后气体体积不变的可逆反应,压强改变不改变平衡移动方向;
B.Y是固体,不影响平衡移动;
C.催化剂只改变反应速率,不影响平衡移动;
D.降低温度正逆反应速率都减小.
B.Y是固体,不影响平衡移动;
C.催化剂只改变反应速率,不影响平衡移动;
D.降低温度正逆反应速率都减小.
解答:
解:A.该反应在反应前后气体体积不变的可逆反应,压强改变不改变平衡移动方向,所以减小容器体积,压强增大,但平衡不移动,故A正确;
B.Y是固体,固体的量的多少不影响平衡移动,所以增大Y的量,Z的百分含量不变,故B错误;
C.加入催化剂增大正逆反应速率,但平衡不移动,则X的转化率不变,故C错误;
D.降低温度,正逆反应速率都减小,平衡向放热反应方向正反应方向移动,故D错误;
故选A.
B.Y是固体,固体的量的多少不影响平衡移动,所以增大Y的量,Z的百分含量不变,故B错误;
C.加入催化剂增大正逆反应速率,但平衡不移动,则X的转化率不变,故C错误;
D.降低温度,正逆反应速率都减小,平衡向放热反应方向正反应方向移动,故D错误;
故选A.
点评:本题考查了温度、压强、催化剂对化学平衡的影响,该反应反应前后气体的计量数之和不变,所以压强不影响平衡移动,注意催化剂和压强、固体不影响该反应平衡移动方向,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
电池在生产、生活中应用越来越广泛.下列说法错误的是( )
| A、化学电源有一次电池、可充电电池和燃料电池等,一次电池只能放电,不能充电 |
| B、铅蓄电池应用广泛,主要优点是单位重量的电极材料释放的电能大 |
| C、燃料电池具有能量利用率高、可连续使用和污染轻等优点 |
| D、锂电池是一种高能电池,体积小、重量轻,单位质量能量比高 |
下列反应的离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| C、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| D、铜和浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
NA为阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,1mol氦气含有2NA个原子 |
| B、在常温常压下,11.2L二氧化硫所含的分子数目为0.5NA |
| C、5.6 g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA |
| D、在常温常压下32g氧气所含的原子数目为2NA |
下列说法正确的是( )
| A、Ksp越小,则该物质在水中的溶解度肯定越小 |
| B、Ksp小的物质不可能转化为Ksp大的物质 |
| C、Ksp的大小只取决于物质属性,而与温度等其它因素无关 |
| D、易溶于水的物质也可能存在沉淀溶解平衡 |
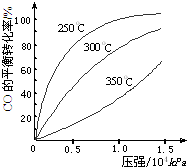 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.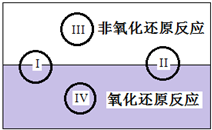 氧化还原反应在生产、生活中具有广泛的用途.
氧化还原反应在生产、生活中具有广泛的用途.